您當前的位置:檢測資訊 > 法規(guī)標準
嘉峪檢測網 2022-01-20 23:16
醫(yī)療器械質量管理體系年度自查報告編寫指南
根據《醫(yī)療器械監(jiān)督管理條例》的規(guī)定,醫(yī)療器械注冊人、備案人、受托生產企業(yè)依據《醫(yī)療器械生產質量管理規(guī)范》及相關附錄的要求,開展醫(yī)療器械生產質量管理體系年度自查工作,編寫并上報質量管理體系年度自查報告,質量管理體系年度自查報告至少包括如下內容:
一、綜述
(一)生產活動基本情況:
包括注冊人、備案人、受托生產企業(yè)基本信息,注冊人、備案人名稱、住所地址、生產地址、生產許可(備案)證號等;
醫(yī)療器械產品注冊證號或備案號以及生產情況(包括委托和受托生產);
創(chuàng)新產品、優(yōu)先審批產品及附條件審批產品情況,企業(yè)參與或獲得國家級、省級、市級重大項目和獎勵情況。
(二)委托與受托生產基本情況:
委托生產情況、受托生產情況及對所委托生產產品的質量管理,包括委托生產產品基本信息、委托與受托生產雙方基本信息、委托生產質量協議、對所委托生產產品的質量管理等。
二、年度重要變更情況
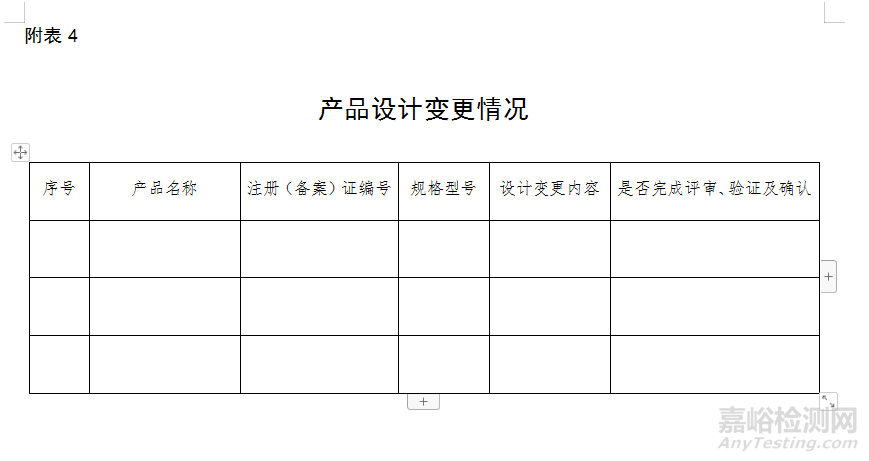
(一)產品設計變更情況:對于與產品安全、性能、預期使用有關的產品設計變更,應對設計變更完成評審、驗證及確認;上報年度產品注冊、備案變更情況。
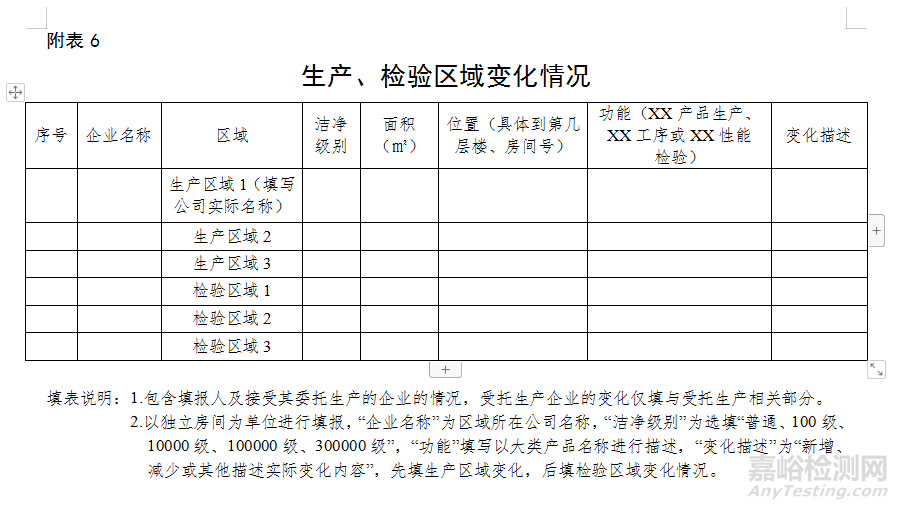
(二)生產、檢驗區(qū)域及生產、檢驗設備變化情況:對生產、檢驗區(qū)域涉及位置、布局及生產、檢驗設備等發(fā)生變化的,描述相關情況。
(三)產品生產工序變化情況:對于關鍵工序、特殊過程發(fā)生變化的,應進行驗證和確認;對關鍵工序、特殊過程進行年度再驗證、再確認的情況。
(四)重要供應商變化情況:對于主要原材料、關鍵原材料的供應商與提供滅菌、檢驗、運輸等服務的重要供應商發(fā)生變化的,應進行評價與再評價。
三、年度質量管理體系運行情況
(一)組織機構及人員培訓情況:包括機構部門、職責、部門負責人、部門人數情況;公司開展的各類培訓情況,包括公司股東、法人參加培訓情況。
(二)生產管理和質量控制情況:
一是生產、檢驗區(qū)域的基本情況;
二是生產設備和檢驗設備的基本情況、檢定校準情況。
(三)采購管理情況:包括依據《醫(yī)療器械生產企業(yè)供應商審核指南》開展供應商審核、評價情況,包含現場及書面審核、評價情況。
(四)顧客反饋情況:顧客投訴的處置情況及客戶退貨產品的處置情況。
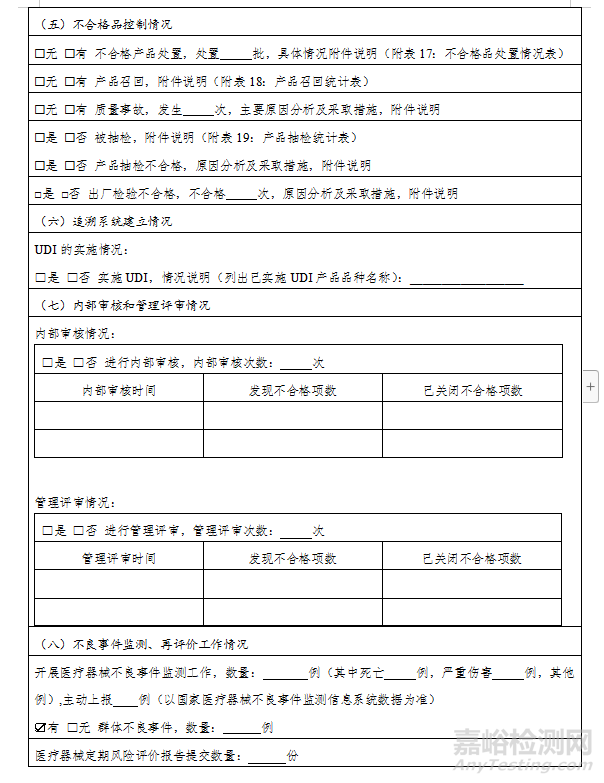
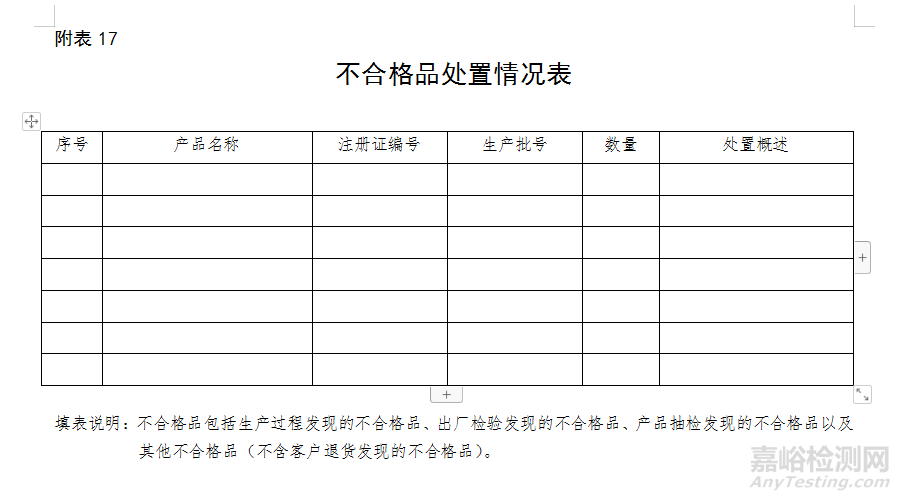
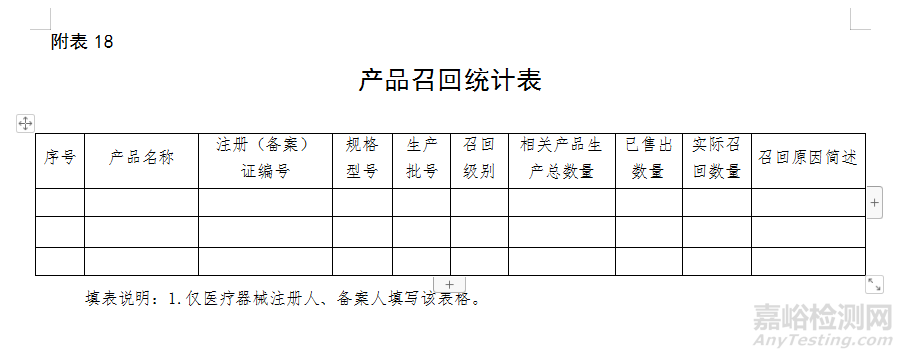
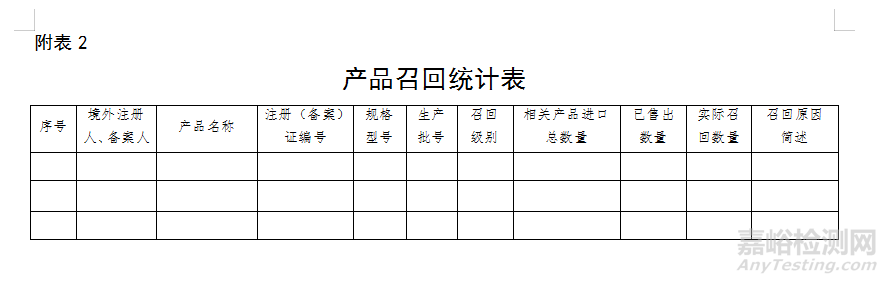
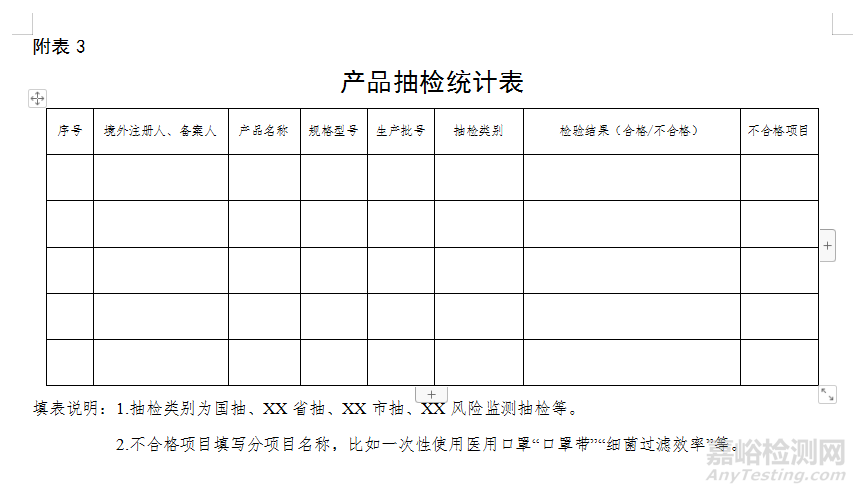
(五)不合格品控制:不合格產品的處置情況、產品召回情況、發(fā)生的質量事故、產品抽檢及發(fā)現的不合格品、出廠檢驗發(fā)現不合格品采取措施的情況及原因分析。
(六)追溯系統(tǒng)建立情況:UDI實施情況。
(七)內部審核和管理評審情況:內審員
一是年度開展內部審核的情況,包括實施的次數、發(fā)現不合格項數及已關閉不合格項數的情況;
二是年度開展管理評審的情況,包括實施的次數、發(fā)現不合格項數及已關閉不合格項數的情況。
(八)不良事件監(jiān)測、再評價工作情況:收集不良事件信息并按規(guī)定上報和開展再評價工作情況,嚴重不良事件的處置情況,醫(yī)療器械定期風險評價報告提交情況等。
四、其他事項
(一)年度接受監(jiān)管或認證檢查情況:年度國內外各級藥品監(jiān)督管理部門對企業(yè)實施的各類監(jiān)督檢查,包括檢查性質、檢查時間、檢查中發(fā)現的主要問題、檢查結論以及整改情況。年度接受其他機構檢查或認證的情況及結果。
進口醫(yī)療器械注冊人、備案人報告接受中國監(jiān)管部門的現場檢查情況,以及接受當地監(jiān)管部門檢查情況(涉及出口至中國產品相關情況)。
(二)年度自查中發(fā)現的主要問題。
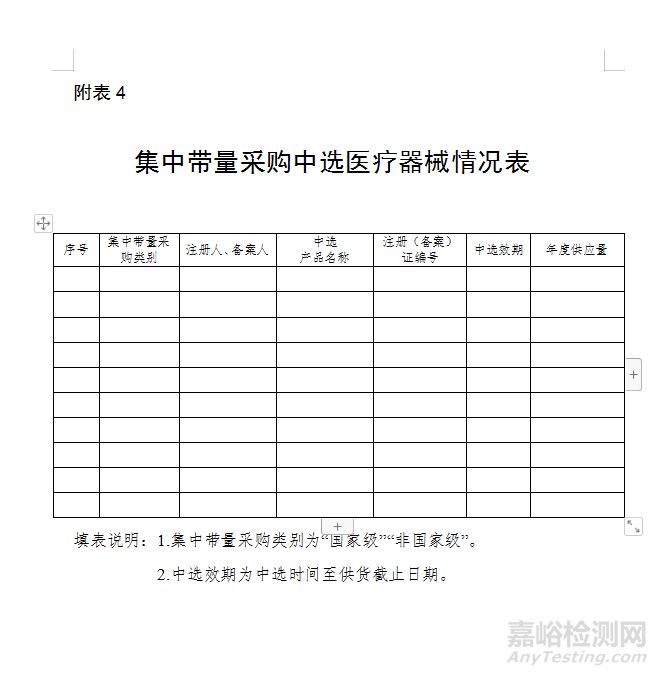
(三)各級集中帶量采購中選醫(yī)療器械情況。
(四)公司接受處罰的情況,進口醫(yī)療器械注冊人、備案人報告內容包括接受其他監(jiān)管部門處罰情況(涉及出口至中國產品相關情況)。
五、填報說明
(一)境內醫(yī)療器械注冊人、備案人填報內容僅涉及在中國大陸地區(qū)注冊上市醫(yī)療器械產品。“二、年度重要變更情況”全部及“三、年度質量管理體系運行情況”中的“顧客反饋情況”“不良事件監(jiān)測、再評價工作情況”“追溯系統(tǒng)建立情況”部分內容僅由注冊人、備案人填報相關情況,受托生產企業(yè)不填寫其接受委托生產產品的上述情況。無生產能力的醫(yī)療器械注冊人、備案人,相關內容填報受托方的相關情況。如果有多于兩家的受托方,對于“三、年度質量管理體系運行情況”需要分別填寫并以“三、年度質量管理體系運行情況(受托方1:XXX)”進行區(qū)別。既具備生產能力也存在委托或者受托生產情況的注冊人、備案人,提交所有要求內容,對于“三、年度質量管理體系運行情況”涉及的注冊人、備案人以及受托方需要分別填寫并以“三、年度質量管理體系運行情況(注冊人、備案人)”“三、年度質量管理體系運行情況(受托方1:XXX)”進行區(qū)別;對于“二、年度重要變更情況”包含注冊人、備案人自己生產及委托生產所有產品相關變更情況。
(二)僅受托生產醫(yī)療器械產品,無醫(yī)療器械注冊證、備案證的生產企業(yè),“二、年度重要變更情況”全部及“三、年度質量管理體系運行情況”中的“顧客反饋情況”“不良事件監(jiān)測、再評價工作情況”“追溯系統(tǒng)建立情況”部分不適用,根據其受托生產的監(jiān)管級別最高的醫(yī)療器械產品確定提交自查報告的藥品監(jiān)督管理部門。
(三)修訂之后的首次填報,不同類型填報主體按照上述填報內容進行填報。后期填報,對境內注冊人、備案人、受托生產企業(yè)若無新增或減少的委托生產或受托生產情況且相關協議無變更的,則“委托生產基本情況”僅填報“委托方履行對受托企業(yè)的質量管理職責(或受托方接受委托人的質量管理)情況”。“三、年度質量管理體系運行情況”中“(二)生產管理和質量控制情況”中“生產、檢驗區(qū)域基本情況”“生產設備和檢驗設備清單”后期不用填報,無變化則不填報的內容參考每項填表說明。
(四)進口醫(yī)療器械注冊人、備案人由其指定的境內代理人向代理人所在省級藥品監(jiān)督管理部門提交自查報告,包含進口醫(yī)療器械注冊產品、銷售情況、上市后管理、不良事件監(jiān)測、再評價、接受檢查以及接受處罰情況等。如代理人同時代理多個不同進口醫(yī)療器械注冊人、備案人,其自查報告應包含其代理的所有進口醫(yī)療器械注冊人、備案人的產品,部分內容應按要求分別填寫。
醫(yī)療器械注冊人、備案人為我國香港、澳門、臺灣地區(qū)的,參照上述要求執(zhí)行。
(五)XXXX年度醫(yī)療器械質量管理體系自查報告的填報內容為當年度1月1日至12月31日統(tǒng)計數據,應于次年1月31日之前向對應的藥品監(jiān)管部門提交。
(六)對自查報告中每部分涉及的內容,如果能夠直接填寫則直接填寫,如果需要以附件形式填寫則以附件形式上傳,并將所有上傳的附件從1號開始依次編號并形成總體附件清單。
附件:
1.醫(yī)療器械質量管理體系年度自查報告編寫模板(境
內醫(yī)療器械注冊人、備案人、生產企業(yè)適用)
2.醫(yī)療器械質量管理體系年度自查報告編寫模板(進
口醫(yī)療器械注冊人、備案人適用)
























來源:Internet


