您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-12-15 11:12
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
今日頭條
國內藥訊
1.智飛新冠疫苗對奧密克戎有效。智飛生物宣布其重組新冠疫苗(CHO 細胞)針對奧密克戎變異株仍具有保護效力。由中科院微生物研究所組織開展的研究結果發現:78%該疫苗的接種者血清對奧密克戎中和抗體檢測陽性,其中免疫第二、三針間隔4個月以上的受試者血清,100%對奧密克戎中和抗體檢測陽性,中和抗體滴度均值較原型毒株下降約3倍。
2.君實PD-1單抗肺癌Ⅲ期臨床積極。君實生物與Coherus聯合開發的特瑞普利單抗在WCLC2021大會上公布一項用于治療晚期鱗狀或非鱗狀非小細胞肺癌(NSCLC)的關鍵性Ⅲ期臨床積極結果。與安慰劑+化療組相比,特瑞普利單抗+化療一線治療顯著改善患者的總生存期和無進展生存期。聯合治療安全性可控,未觀察到新的安全性信號。兩家公司計劃盡快向FDA遞交監管申請。
3.西比曼雙靶點CAR-T在美獲批臨床。西比曼生物新型CD19/CD20雙靶點CAR-T產品C-CAR039獲FDA批準,將在美國進一步推進后續的臨床開發。公布于ASCO2021年會上的最新數據顯示,C-CAR039治療復發/難治性B細胞非霍奇金淋巴瘤的總緩解率為92.6%,完全緩解率達到85.2%,中位至緩解時間為1.0個月。此前,FDA已授予C-CAR039用于治療濾泡性淋巴瘤(一種惰性非霍奇金淋巴瘤)的孤兒藥資格。
4.齊魯制藥引進乙肝RNAi療法。齊魯制藥與Arbutus Biopharma就后者RNAi藥物AB-729達成合作和許可協議。AB-729擬開發用于治療或預防乙型肝炎,目前處于Ⅱa期概念驗證臨床階段。根據協議,齊魯將獲得AB-729在大中華區(包括中國大陸、香港、澳門、臺灣地區)的開發和商業化獨家授權。Arbutus將獲得4000萬美元的預付款和1500萬美元的股權投資,可能高達2.45億美元的里程碑后付款,以及合作產品的銷售分成。
5.翰森制藥引進血液疾病新藥。翰森制藥子公司翰森健康與Keros公司達成合作協議,將獲得Keros處于II期臨床、工程化配體陷阱KER-050在中國大陸、香港及澳門地區開發、生產及商業化權益。KER-050目前正被開發用于骨髓增生異常綜合癥(MDS)患者和骨髓纖維化(MF)患者血細胞減少(包括貧血和血小板減少)的治療。根據協議,Keros將獲得2000萬美元首付款和最多1.705億美元的里程碑潛在付款,以及產品的銷售分成。
6.百濟神州購進維立志博LAG-3抗體。百濟神州與維立志博就后者擬用于晚期實體瘤的LAG-3抗體LBL-007達成授權和合作協議,百濟神州將獲得LBL-007的全球研發和生產許可,以及中國境外的獨家商業化權利。LBL-007目前已獲得美國和中國的臨床許可,在中國處于Ⅰb/Ⅱ期臨床階段。根據協議,維立志博將獲得3000萬美元首付款,至多7.42億美元的里程碑后付款,以及產品的銷售分成。
國際藥訊
1.泌尿科疾病口服復方獲FDA批準上市。FDA批準Veru公司口服復方配方Entadfi(非那雄胺/他達拉非)上市,用于治療良性前列腺增生(BPH)引發的尿路癥狀。非那雄胺目前獲批用于治療BPH和雄性激素源性脫發,他達拉非獲批用于治療BPH和男性勃起功能障礙。在臨床試驗中,與非那雄胺單藥治療相比,Entadfi在治療BPH引起的尿路癥狀方面更有效,并且伴有較小的不良副作用。
2.羅氏A型血友病新藥Ⅲ期臨床積極。羅氏雙特異性抗體Hemliba(Emizumab,艾美賽珠單抗)治療體內無因子VIII抑制物的輕中度A型血友病的Ⅲ期臨床HAVEN 6中期結果積極。Hemlibra表現出良好的安全性和有效的出血控制,80.3%的患者沒有發生需要治療的出血事件,90.1%的患者沒有發生需要治療的關節出血。年化出血率(ABR)較低,與之前報告的HAVEN 1-4研究結果一致。
3.IL-4/13抑制劑治療嬰幼兒皮炎臨床積極。賽諾菲與再生元開發的重磅IL-4/IL-13抑制劑Dupixent在RAD 2021年會上公布治療6個月至5歲中重度特應性皮炎患者的Ⅲ期試驗Liberty Ad Preschool積極數據。與安慰劑相比,Dupixent聯合皮質類固醇顯著提高第16周皮膚達到病癥完全清除或幾乎完全清除的患者比例(28%vs4%),該組有53%的患者總體疾病嚴重程度(美國以外地區的共同主要終點)較基線改善了75%或更高,而對照組僅為11%,而且安全性數據與成人的安全性相當。賽諾菲計劃盡快在歐美提交監管申請。
4.創新P2X3受體拮抗劑Ⅱ期臨床積極。BELLUS Health公司選擇性口服P2X3受體拮抗劑BLU-5937治療難治性慢性咳嗽(RCC)的Ⅱb期臨床結果積極。50 mg和200 mg BLU-5937組第28天時經安慰劑調整的24小時咳嗽頻率降低34%,具有統計學意義(p≤0.005),12.5 mg BLU-5937組這一數值降低21%(p=0.098),且在12.5 mg組和50 mg組之間觀察到劑量依賴效應。BLU-5937的安全性等數據與之前試驗一致。預計明年第2季度啟動Ⅲ期臨床項目。
5.禮來布局染色質調控技術平臺。禮來旗下Loxo Oncology與Foghorn Therapeutics將利用后者針對染色質調控系統的“基因交通管制”(Gene Traffic Control)技術平臺,聯合開發三個新型腫瘤學候選藥物,以及共同開發和推廣Foghorn的選擇性BRM蛋白抑制劑和另外一個未公開的腫瘤學靶點。根據協議,Foghorn將獲得3億美元的前期付款和8000萬美元的股權投資,潛在總金額為13億美元的開發和里程碑付款,以及產品的銷售分成。
6.輝瑞擬斥資約67億美元收購Arena。輝瑞與Arena公司達成協議,將斥資約67億美元收購Arena,獲得其免疫炎癥性疾病在研藥物etrasimod,以及心血管在研藥物temanogrel和APD418。etrasimod是新一代口服S1P調節劑,正在開發用于治療包括胃腸道和皮膚病在內的一系列免疫炎癥性疾病。Temanogrel正在Ⅱ期臨床中治療繼發于系統性硬化癥的微血管阻塞和雷諾現象。APD418處于急性心力衰竭的Ⅱ期臨床階段。
醫藥熱點
1.中國內地首次檢出奧密克戎變異株。天津市疾控中心對12月9日境外輸入新冠病毒無癥狀感染者呼吸道標本進行新冠病毒全基因組測序和序列分析,經中國疾控中心復核,確認為檢出新冠病毒奧密克戎變異株(B.1.1.529進化分支)。在津感染者系入境閉環管控人員,目前于定點醫院隔離治療。據悉,這是中國內地首次發現新冠病毒奧密克戎變異株。
2.新增14家現代醫院管理制度試點單位。12月13日,國家衛健委發布《國務院醫改領導小組秘書處關于新增建立健全現代醫院管理制度試點醫院的通知》,決定新增首都醫科大學附屬北京天壇醫院等14家醫院為新一批試點醫院。《通知》要求各試點醫院要建立健全試點工作的組織領導和工作推進機制,細化實化改革任務。自2018年底開展現代醫院管理試點工作以來,目前試點醫院數量達到161家。
3.浙江全國首發醫院陪護服務合同范本。全國首個醫院陪護服務合同示范文本——《浙江省醫院陪護服務合同(示范文本)》于近日出臺,將于明年1月起在全省范圍內生效實施。《示范文本》分別制定了三方居間合同和雙方合同,明確醫院陪護服務合同的兩種類型,厘清主體間法律關系。同時,還對醫院陪護服務涉及主體的權利義務作出規范。
評審動態
2. FDA新藥獲批情況(北美12月13日)
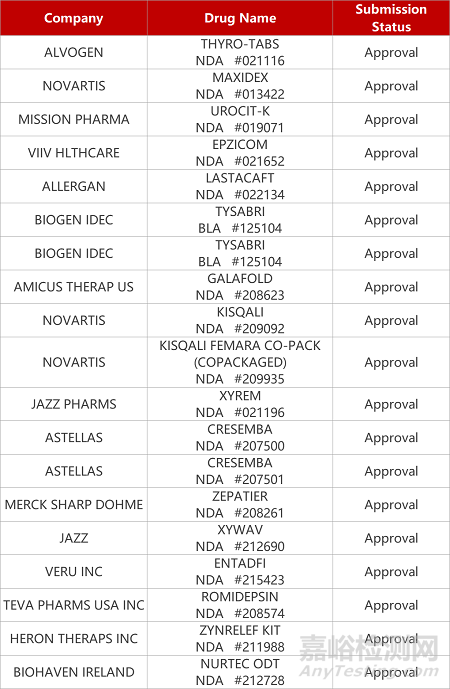

來源:藥研發


