您當前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2021-11-12 10:50
更多醫(yī)藥技術(shù)資訊,請點擊醫(yī)藥專欄:http://drug.anytesting.com/ 歡迎關(guān)注文末微信公眾號:藥研檢測drugtest
「 本文共:15條資訊,閱讀時長約:3分鐘 」
今日頭條
中國新藥注冊臨床年度報告出爐。CDE發(fā)布《中國新藥注冊臨床試驗現(xiàn)狀年度報告(2020年)》,首次對中國新藥注冊臨床試驗現(xiàn)狀匯總分析。2020年共登記臨床試驗2602項,較2019年增長9.1%。化學藥(約73.6%)和生物制品(23.8%)占比較高,其中新療法在生物制品中的占比達到4.3%;化藥、治療用生物制品、預(yù)防用生物制品和中藥的注冊分類中占比最高的均為1類,分別為71%、65.4%、46.0%和61%;靶點主要為PD-1、VEGFR、PD-L1等,細胞治療仍以CD19靶點為主。
國內(nèi)藥訊
1.司美格魯肽啟動抗AD國際Ⅲ期臨床。諾和諾德口服司美格魯肽(semaglutide,GLP-1類似物)在中國登記啟動一項用于治療早期阿爾茨海默病患者的Ⅲ期臨床(EVOKE plus)。這是一項國際臨床項目,計劃在中國境內(nèi)入組115人,在國際入組1840人。首都醫(yī)科大學宣武醫(yī)院主任醫(yī)師賈建平教授將擔任中國臨床研究的主要研究者。來自semaglutide治療糖尿病的三項大型心血管結(jié)局試驗(LEADER、SUSTAIN 6和PIONEER 6)的事后分析顯示,服用GLP-1的患者癡呆癥的發(fā)生率顯著降低了53%。
2.澳宗生物TTYP01獲ALS孤兒藥資格。蘇州澳宗生物依達拉奉改良型新藥TTYP01片獲FDA授予孤兒藥資格,用于治療肌萎縮側(cè)索硬化癥(ALS,俗稱漸凍人癥)。澳宗生物在已上市依達拉奉注射劑型的安全性和有效性數(shù)據(jù)基礎(chǔ)上,通過特有的專利技術(shù)改變給藥途徑,將依達拉奉注射劑改良成口服的片劑,可為患者提供長達一年以上的持續(xù)治療。在中國,TTYP01片的NDA申請預(yù)計將于明年獲批。
3.勤浩醫(yī)藥SHP2抑制劑獲批臨床。勤浩醫(yī)藥1類新藥GH21膠囊獲國家藥監(jiān)局臨床試驗?zāi)驹S可,擬開發(fā)用于晚期實體瘤的治療。GH21是一款小分子SHP2抑制劑,已在臨床前研究中顯示出極強的生物活性,對多種SHP2點突變體有效;并具有脫靶風險低,GH21代謝性質(zhì)優(yōu)異,口服生物利用度高和安全性良好的特點。2020年9月,勤浩醫(yī)藥已將GH21的中國以外的開發(fā)和商業(yè)化權(quán)利授予滬亞生物。
4.新型鈣通道阻滯劑獲批PSVT臨床。箕星藥業(yè)引進的鼻噴霧劑etripamil獲國家藥監(jiān)局臨床試驗?zāi)驹S可,擬開發(fā)用于治療成人陣發(fā)性室上性心動過速(PSVT)發(fā)作,快速轉(zhuǎn)復(fù)為竇性心律。etripamil是Milestone公司開發(fā)的一款新型鈣通道阻滯劑,目前處于治療PSVT的Ⅲ期臨床階段,以及治療心房顫動伴快速心室率(AFib-RVR)患者的Ⅱ期概念驗證試驗階段。
5.默沙東ROR1-ADC報IND。默沙東ROR1-ADC新藥zilovertamab vedotin(MK-2140)的臨床試驗申請獲CDE受理。ROR1(受體酪氨酸激酶樣孤兒受體1)是一種跨膜受體,它存在于多種血液系統(tǒng)惡性腫瘤中,包括慢性淋巴細胞白血病 (CLL)、套細胞淋巴瘤 (MCL) 和彌漫性大B細胞淋巴瘤 (DLBCL)。MK-2140是國內(nèi)首款申報臨床的ROR1 ADC。目前全球尚無同靶點藥物獲批上市;同類藥物開發(fā)進度最快的是Oncternal公司處于II期階段的cirmtuzumab。
6.天境生物與濟川藥業(yè)達成戰(zhàn)略合作。濟川藥業(yè)與天境生物就后者擬用于兒童生長激素缺乏癥的伊坦生長激素(eftansomatropin alfa,TJ101)達成戰(zhàn)略合作,濟川藥業(yè)將獲得這款長效重組人生長激素TJ101在中國大陸地區(qū)的開發(fā)、生產(chǎn)及商業(yè)化的獨家許可。根據(jù)協(xié)議,天境生物將獲得人民幣2.24億元(不含稅)的首付款、不超過人民幣17.92億元(不含稅)的開發(fā)及銷售里程碑付款,以及產(chǎn)品的銷售提成。
國際藥訊
1.艾力雅在歐盟和日本報新適應(yīng)癥。拜耳阿柏西普眼內(nèi)注射溶液Eylea(艾力雅®)已在歐盟和日本提交新的適應(yīng)癥申請,用于早產(chǎn)兒視網(wǎng)膜病變(ROP)的治療。Eylea是一種新型玻璃體內(nèi)注射用VEGF抑制劑,是一種重組融合蛋白。在一項Ⅲ期FIREFLEYE研究中,與激光手術(shù)相比,Eylea治療的成功率更高(85.5%vs82.1%),而且Eylea的安全性和耐受性良好。
2.蘑菇致幻成分治療抑郁Ⅱb期臨床積極。COMPASS Pathways裸蓋菇素療法COMP360治療難治性抑郁癥的Ⅱb期臨床達到主要終點。與1 mg COMP360組(對照組)相比,25 mg COMP360組第3周時評估抑郁癥狀的MADRS評分降低6.6(p<0.001),而且第12周時獲得持續(xù)緩解的患者比例更多(24.1%vs10.1%)。該新藥通常耐受良好。裸蓋菇素(psilocybin)是源于毒蘑菇中的致幻活性成分。
3.TIL療法聯(lián)合PD-1治療實體瘤臨床積極。Iovance Biotherapeutics公司TIL療法lifileucel聯(lián)合PD-1抑制劑帕博利珠單抗(Keytruda)一線治療晚期實體瘤的臨床結(jié)果積極。最新數(shù)據(jù)顯示,這一組合在宮頸癌患者中ORR達到50.0%;在轉(zhuǎn)移性黑色素瘤和頸部鱗狀細胞癌患者中ORR分別為87.5%和ORR為42.9%。所有隊列的不良事件特征與已知的不良事件特征一致。
4.創(chuàng)新TCR免疫療法組合早期臨床積極。Immunocore公司靶向TCR/CD3的免疫療法tebentafusp聯(lián)合PD-L1抑制劑durvalumab和/或CTLA4抑制劑tremelimumab治療轉(zhuǎn)移性皮膚黑色素瘤(mCM)的Ⅰb期臨床結(jié)果積極。在免疫檢查點抑制劑經(jīng)治患者中,tebentafusp加durvalumab聯(lián)合/不聯(lián)合tremelimumab的最大目標劑量在雙聯(lián)和三聯(lián)組中均可耐受;tebentafusp治療的1年總生存率(OS)達到76%。詳細結(jié)果將在SITC2021年會上公布。
5.基因泰克布局微生物組學療法。Novome公司與羅氏旗下基因泰克達成一項合作和許可協(xié)議,將利用Novome專有的基因工程微生物藥物(GEMMs)平臺,聯(lián)合開發(fā)用于人類腸道疾病的治療性工程菌定植療法。根據(jù)協(xié)議,Novome將獲得1500萬美元的預(yù)付款,可能高達5.9億美元的潛在里程碑付款。Novome將負責合作項目的臨床前研究,基因泰克將負責候選藥物的臨床開發(fā)和商業(yè)化。
6.輝瑞引進兩款偏頭痛藥物。輝瑞與Biohaven公司就后者的兩款偏頭痛藥物(Rimegepant和Zavegepant)達成許可協(xié)議,輝瑞將獲得這兩款新藥在美國境外商業(yè)化權(quán)利。Rimegepant是唯一一款獲FDA批準用于治療急性偏頭痛和預(yù)防偏頭痛發(fā)作的口服CGRP拮抗劑;Zavegepant正在III期臨床中評估治療偏頭痛的潛力,此外,它還在臨床中用于治療新冠病毒感染和哮喘。根據(jù)協(xié)議,Biohaven將獲得5億美元首付款、7.4億美元的里程碑付款,以及產(chǎn)品的銷售分成。
醫(yī)藥熱點
1.中西醫(yī)結(jié)合醫(yī)學中心設(shè)置標準發(fā)布。國家衛(wèi)健委、國家中醫(yī)藥管理局聯(lián)合發(fā)布《國家中西醫(yī)結(jié)合醫(yī)學中心(綜合醫(yī)院)設(shè)置標準》。《設(shè)置標準》強調(diào),國家中西醫(yī)結(jié)合醫(yī)學中心(綜合醫(yī)院)應(yīng)為中西醫(yī)結(jié)合診療水平全國領(lǐng)先的三級甲等綜合醫(yī)院,具備涵蓋多個專業(yè)的獨立設(shè)置中西醫(yī)結(jié)合或中醫(yī)科室,中西醫(yī)結(jié)合、中醫(yī)執(zhí)業(yè)醫(yī)師占全院醫(yī)師比例不低于10%。
2.英國國家醫(yī)療服務(wù)體系瀕臨崩潰。據(jù)英媒報道,英國國家醫(yī)療服務(wù)體系(NHS)聯(lián)合會近期進行的一項調(diào)查顯示,NHS目前有超過9萬人的崗位空缺,社會保障方面的人員缺乏更為嚴重。人員短缺問題已導致醫(yī)院、診所和急診部門很難應(yīng)對日益增長的需求,患者安全無法得到保障,面臨巨大風險。
評審動態(tài)
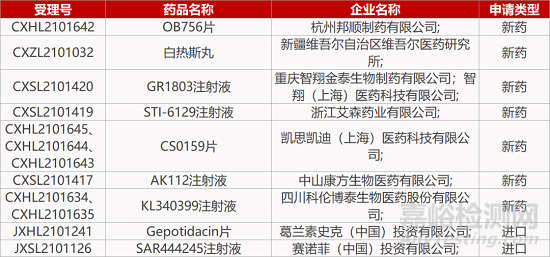
1. CDE新藥受理情況(11月11日)

來源:藥研發(fā)


