您當前的位置:檢測資訊 > 行業研究
嘉峪檢測網 2021-09-29 23:55
摘要
注:本文統計的數字僅針對歐盟市場
目前市場上至少 22% 的 IVD 檢測將停止,如果找不到緊急解決方案來解決現有的 IVD 法規過渡問題,將會失去更多的 IVD產品。
額外的損失是可以避免和預防的。
最大的損失比例將來自中小型制造商,其中生產小批量小眾產品的制造商更容易受到影響。
制造商在認證過程中面臨的第一個障礙是可用的公告機構數量不足。
關鍵數字
該調查覆蓋了90%的市場收入;IVD產品將會不可避免的減少22%(通過比較IVDD下的器械數量和打算在IVDR下獲得CE標識的器械數量)。
需要公告機構認證的檢測會增加%736。
在最壞的情況下,僅有24%的產品會留存在市場上(其中許多是最低風險的 A類,不能獨立使用,只能與更高級別的B、C和D類設備結合使用)。
僅有47%的制造商與公告機構簽訂了合作協議,以根據新的 IVDR 評估和認證其質量管理體系和 IVD;此外,這樣的框架協議還不能保證公告機構可以涵蓋和評估監管范圍內制造商所有的產品。
MedTech Europe 調查報告——分析 2022 年 5 月新歐盟 IVD 法規適用時體外診斷醫療器械 (IVD) 的可用性
調查由醫療器械主管部門 (CAMD) 關于認證能力監測的特別小組委托進行
介紹
為配合過去 20 年技術和醫療保健的重大發展,歐盟修訂了管理體外診斷醫療設備 (IVDs)的法律。現有的 IVD 指令 (IVDD) 于 1998 年首次發布,并將于 2022 年 5 月 26 日被新的 IVD 法規 (IVDR) 取代。歐盟新的 IVD 法規于 2017 年 5 月與非體外診斷醫療器械新法規同時生效。當時,歐盟的首要任務是確保建立健全、透明和可持續的監管框架并保持高度安全等級,同時支持IVDs和醫療器械的創新。
新法規旨在在醫療器械的三年過渡期(因新冠疫情延長至四年)和 IVD 的五年過渡期后取代現有指令。IVD部分的時間比MD部分多兩年(現在減少到一年),以說明新的 IVD 監管要求發生了更重大和深刻的轉變,需要比以往任何時候都要多的基礎設施和能力。
更多的IVDs產品將受到公告機構的審查,并且需要根據法規獲得新的(或更新的)認證。早期的預估表明,按照 80:20 的比例劃分,即80% 的設備不需要 IVDD 下的認證,而 20% 的設備需要。預計 IVDR 會將其逆轉至 20:80——20% 的設備不需要認證,80% 的設備需要。本次調查的結果表明,即便如此,這也是一個低估:在 IVDD 下,實際拆分比例為 92:8,在新法規下為 22:78。即,根據 IVD 法規,需要公告機構頒發證書的設備占市場上總數的 78%,而在 IVD 指令下,這一比例僅為 8%。
由于需要證書的設備數量發生巨大變化,公告機構的能力對于歐盟 IVDR 的成功至關重要。然而現有 IVDD 指定了 18 個公告機構,但只有 6 個公告機構指定給 IVDR,其中大部分是最近指定的。另一方面,醫療器械法規近期指定的公告機構足有 22 個。
調查方法
為了準備即將由過渡到新的 IVD 監管框架,歐盟醫療器械主管當局 (CAMD) 委托 MedTech Europe 對 IVDR 市場進行調查。
在2021年7月8日至28日中,該調查發送給 MedTech Europe 的所有 IVD 制造商成員,并鼓勵國家協會邀請自己的制造商成員參與,每個制造商只允許提交一份。數值結果已匯總并根據法律免責聲明發布。MedTech Europe 已于 8 月 12 日向CAMD和歐盟委員會共享了一份初步報告。在該報告中,我們還包括了關于公告機構和 IVDR 過渡的個人匿名評論——個人評論不會作為本報告的一部分發布,但是,MedTech Europe 總結了該部分下的主題題為“IVDR 過渡——受訪者提出的個人意見”。
115家廠商參與了本次調查. 這代表了預計90% 的市場收入覆蓋率。大多數受訪者 (82) 是中小型企業 (SME),33 人來自大型制造商。
結果總結
打算從 IVDD 過渡到 IVDR 的產品數量與現有指令下的 39844 個IVDs 相比,制造商希望將多達 31118 個IVDs過渡到新法規中。這意味著 22% 的 IVD 將不可避免地無法用于患者的健康服務。
最大的損失將來自中小企業制造商,其中許多制造商生產利基產品,可能無法承受業務損失。
目前尚不清楚歐盟和全球衛生系統在多大程度上為這種不可避免的損失做好了準備。

IVD指令下現有認證過渡到新的 IVD 法規– “寬限期”
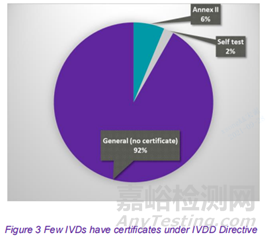
目前 92%的IVDs不需要具有公告機構的認證。在指令 (IVDD) 附件 II 中列出的或用于自檢的8%的IVDs需要認證。如果頒發認證的公告機構同意,則制造商可能能夠利用IVD 法規 (IVDR) 第 110(3) 條中的關于過渡期規定,最多到2024年5月的“寬限期”。
對于無法在 IVDD 下申請認證的 92% 的 IVDs,制造商沒有寬限期,必須從 2022 年 5 月開始全面應用 IVDR
第 110(4) 條中關于已經在供應鏈中的器械的“拋售(sell-off)”條款對于有效期有限的試劑(B 、C 、D 類 IVDs)的價值非常有限。“拋售”期對于有效期較長的產品(例如儀器,其中絕大多數不需要 IVDR 認證)更為重要。
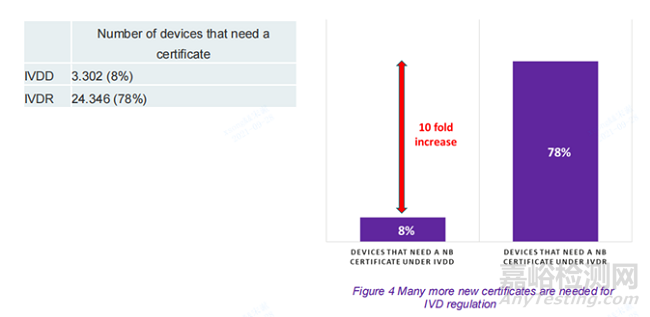
IVDR 所需的新認證的數量
作為IVDR的結果,78%的設備將需要新認證(包括需要更新現有認證的設備)。這意味著與 IVDD 相比,需要證書的 IVD 增加了 736%。此數據對于意識到需要多少公告機構來支持 IVDR 下的認證過程非常重要。
IVDR的認證狀態
需要進行IVDR認證的12%IVDs已經獲得了新認證。制造商預計預測這個比例到 2022 年 5 月的應用日期之前至少能提高到28%。
|
至今頒發了 IVDR 認證的設備數量 |
未提供信息的設備數量(如果可以按時頒發IVDR認證) |
到 2022 年 5 月不會頒發 IVDR 認證的設備數量 |
|
2878 |
14584 |
6874 |
雖然調查數據表明,21%的制造商在完成認證方面沒有問題,但可以預計60%的產品會面臨不同程度的未按時認證的風險。這是因為目前距離應用時間僅剩不到九個月,而公告機構預測新認證的頒發時間為 10 到 14 個月。理想情況下,制造商在頒發證書后需要大約六個月的時間來制造和標識設備,以便將測試菜單的可用性傳達給實驗室和醫療保健專業人員,將設備提供給供應鏈并確保為用戶提供一致的可用性,而注冊設備以出口到國際市場可能需要長達 12 個月的時間。
某些IVDs需要額外的認證程序
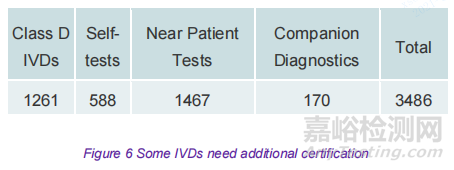
對于某些 IVDs,在公告機構頒發所需的認證之前需要額外的流程。其中包括 D 類 IVDs、伴隨診斷和用于自檢或近患檢驗的設備。所有這些設備都需要單獨的歐盟技術文件評估;D類和伴隨診斷進一步需要特定機構在認證過程中干預。由于公告機構工作量增加和容量不足,這些 IVDs 可能會因認證延遲而受到不同程度的影響。在最近的發布,由于缺乏認證所需的基礎設施和時間,D類設備將于 2022 年 5 月獲得認證會增加不確定性。
最好和最壞的情況
在從 IVDD 過渡到 IVDR 的過程中,制造商預測,在歐盟市場將失去最少目前22%的IVDs。如果不立即采取行動,預計會失去更多產品。在這里,我們提出了最好的情況和最壞的情況,以詳細說明損失的潛在程度。
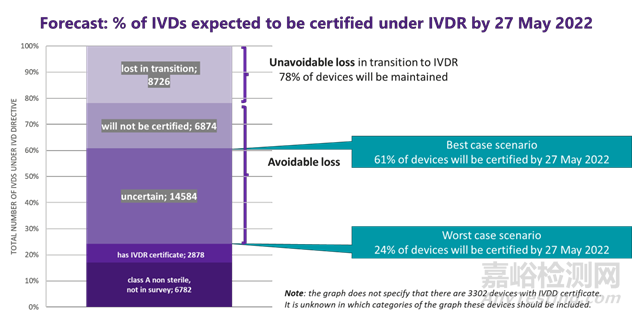
我們計算出已有IVDR認證的產品、A類非無菌的IVDs以及不在上圖里有IVDD認證的產品數量占24%歐IVD 市場的份額,其中3302 擁有現有 IVDD 認證的 IVDs可能有資格享受寬限期的資格;如果不采取任何措施,在最壞的情況下,這些可能是IVDR應用日期后所有可用的設備(當然,預計到 2022 年 5 月會有一些額外的認證)。重要的是要了解 A 類設備本身不足以提供 IVD 醫學檢測;A 類 IVD(例如儀器、僅驅動和影響的軟件、緩沖溶液、其它附件)幾乎總是需要與一種或多種 B、C 或 D 類試劑結合使用。
如果不采取進一步行動,即使在最好的情況下,我們預測從 2022 年 5 月起歐盟市場39%的IVDs將無法使用。
認證阻礙:公告機構的能力
本調查提供了定量和定性數據,以說明為什么在 2022 年 5 月,公告機構認證涵覆蓋IVDs如此之少。53%的受訪者未與公告機構達成協議。即使有協議,也不能保證在 IVDR 應用之日及時認證哪些或多少設備。74%的受訪者發現在開始或完成認證方面存在一些障礙。在這里,公告機構的能力和其他基礎設施的缺乏是制造商對此的回應。
|
阻礙 |
所占百分比 |
含義 |
|
尚未指定 |
29% |
制造商正在與IVDD下但未被IVDR指定的公告機構合作 |
|
回應時間延遲 |
26% |
公告機構的回應有延遲 |
|
申請未被接受 |
20% |
制造商已經向公告機構遞交申請,但申請被拒絕 |
|
無法趕上最后期限 |
15% |
公告機構已提醒制造商,他們的部分或所有產品無法在2022年5月之前獲得認證 |
|
選擇性認證 |
10% |
公告機構無法處理某些器械的申請(如D類、CDx等),或要求制造商確認哪些器械需要優先認證 |
許多制造商一直在 IVDD 和/或 ISO 13485 下與尚未在 IVDR 下指定的公告機構合作。由于需要重新進行 ISO 13485 認證并根據新的公告機構程序調整文檔,因此過渡到新的公告機構需要一定的時間。
對于其它制造商,公告機構對合同和協議請求的響應時間被延遲,或者請求被公告機構拒絕。在有協議的情況下,一些制造商指出,他們的公告機構警告他們,并非所有產品都能在申請之日獲得認證;即使制造商已完成必要的工作以準備新的認證,也有需要對產品進行優先排序。
認證阻礙:其他基礎設施的缺失
其他缺失的基礎設施問題包括 EUDAMED、歐盟參考實驗室和專家小組。許多人提到迫切需要指導文件。如果沒有指導文件,制造商、公告機構和主管當局做出不一致決定所造成的風險會更大。制造商必須花費時間和金錢來制定自己的解決方案,然后在發布指南后檢查解決方案是否仍然有效。調查中提到的主要指導文件包括:
1 、性能評估–調整現有的臨床證據或為新產品創建新的臨床證據。
2 、OEM(“原始設備制造商”)產品——許多 IVDs是由合法制造商重新貼上標簽和重新命名,他們以自己的名義將設備投放市場。而某些信息是專有的,原始制造商可能不愿意因新的法律法規共享此信息制造商。目前尚不清楚這種做法如何或是否可以在 IVDR 下繼續下去。
3 、D類審查——新的分類規則意味著將有許多新的D類IVDs從未獲得認證,除非有通用規范,否則在頒發認證之前會受到專家小組的額外審查。IVD只有一個專家組(而醫療器械則為 10 個)。目前尚不清楚專家小組將審查什么、他們決策的依據是什么以及如何與歐盟參考實驗室驗證過程配合使用。
4 、伴隨診斷——藥品管理部門審查公告機構認證的某些方面的新要求意味著仍有相當多的關于兩個組織將如何互動的不確定性(例如,共享什么信息、決策依據和時間表)。
5 、臨床試驗的測定——目前尚不清楚新藥臨床試驗中使用的哪些檢測方法需要滿足新的 IVDR 要求。
結論
70% 的臨床決策是通過 IVDs 做出的。IVDs 的影響不應被低估。我們也不應低估IVDs的損失對歐盟醫療保健系統的影響。本調查預測,從最高風險到最低風險級別的 IVDs,包括伴隨診斷、自我測試和近患者測試等類別的IVDs都將受到影響。
缺乏 IVDR 基礎設施是造成這種預期和可避免損失的主要原因。在新法規的早期,提高公告機構的能力、創建指南和其他基礎設施似乎是可能的,但隨著應用日期的臨近,時間已經不夠了。
IVDR 下IVDs認證的數量需要的公告機構的是IVDD的十倍。
缺少歐盟委員會立即采取的行動,歐盟會失去大約22%至76%的IVDs。
小中型企業最有可能受到影響。
本調查表明,迫切需要就 IVDR 監管框架和快速臨近的應用日期采取行動,以保護和支持歐洲的醫療診斷。

來源:致眾醫療器械資訊


