您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-08-02 18:33
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
今日頭條
國內藥訊
1.康方/正大天晴PD-1單抗即將獲批。康方生物與正大天晴聯合開發的PD-1單抗藥物派安普利單抗(研發代號:AK105)上市申請(受理號:CXSS2000022)已進入“行政審批”階段,預計即將獲NMPA批準上市,成為國內第5款國產PD-1單抗,用于治療至少經過二線系統化療復發或難治性經典型霍奇金淋巴瘤(r/r cHL)患者。在一項I/II期AK105-201研究中,AK105三線治療的ORR達到89.4%。CR達到48.2%,明顯高于歷史對照。目前,該新藥的第2項適應癥上市申請已獲CDE受理。
2.BMS奧扎莫德膠囊在華報NDA。百時美施貴寶新藥奧扎莫德(ozanimod)膠囊的上市申請獲NMPA受理。Ozanimod是一款S1P受體調節劑,已于2020年3年首次獲FDA批準上市,用于治療成人復發型多發性硬化癥(RMS),包括臨床孤立綜合征、復發緩解型多發性硬化癥以及活動性繼發進展型多發性硬化癥。并于今年5月獲FDA批準用于治療中重度活動性潰瘍性結腸炎。Ozanimod此次申報適應癥推測為治療克羅恩病。
3.澤布替尼又一項國際Ⅲ期臨床積極。百濟神州評估BTK抑制劑澤布替尼(百悅澤)與苯達莫司汀聯合利妥昔單抗(B+R)用于治療初治慢性淋巴細胞白血病(CLL)或小淋巴細胞淋巴瘤(SLL)患者的國際Ⅲ期SEQUOIA試驗獲積極中期分析結果。中位隨訪25.8個月時,澤布替尼相較B+R在IRC評估的無進展生存期(PFS)方面顯示出統計學意義的顯著改善;研究者評估的PFS也具有統計學意義;澤布替尼的耐受性總體良好,安全性特征與已知研究一致。
4.羅氏兩款新藥擬納入突破性療法認定。羅氏兩款抗體藥物獲CDE擬納入突破性治療品種,分別為CD3/CD20雙抗Glofitamab(RO7082859)和C5單抗藥物Crovalimab(RO7112689)。Glofitamab本次擬突破性療法認定的適應癥為經兩線或多線系統治療后的復發或難治性成人彌漫大B細胞淋巴瘤患者 (r/r DLBCL)。而Crovalimab是羅氏的新一代補體C5抑制劑,擬用于陣發性睡眠性血紅蛋白尿(PNH)。羅氏計劃明年在中國首先遞交 Crovalimab上市申請。
5.鑫康合IL-25單抗獲FDA批準臨床。鑫康合生物研發的擬用于治療炎癥和過敏疾病創新藥物XKH001獲FDA臨床許可。XKH001是鑫康合生物醫藥自主開發的、具有全球知識產權的“First in Class”IL-25單抗,已在臨床前研究中顯示出良好的藥效、藥代動力學特性和安全性。目前全球同靶點藥物均處于臨床前開發階段;XKH001是全球首個FDA批準進入臨床的IL-25抑制劑。
國際藥訊
1. 首款IL-5抗體在美獲批治療鼻竇炎。FDA批準葛蘭素史克抗IL-5單抗Nucala用于維持治療對鼻用類固醇應答不足并伴有鼻息肉的慢性鼻炎。Nucala(mepolizumab)也是FDA批準用于這類患者的首個抗IL-5生物制品。在一項關鍵性SYNAPSE研究中,與安慰劑相比,Nucala聯合標準治療使患者再次接受手術的患者比例降低57%(HR=0.43,95% CI:0.25,0.76);52周期間需要使用全身性皮質類固醇的患者比例也較低。
2. 降糖可交換生物類似藥獲FDA批準。FDA批準邁蘭制藥的甘精胰島素生物類似藥Semglee作為賽諾菲長效胰島素類似物Lantus的可交換生物類似藥,用于治療成人和兒童1型糖尿病、成人2型糖尿病。去年6月,Semglee已獲FDA批準上市,用于沒有使用過Lantus的糖尿病患者,這是FDA批準的首款可交換生物類似藥。在臨床研究中, Semglee在接受過Lantus治療的患者中具有相同的臨床療效,在Semglee和Lantus之間轉換安全性與有效性降低的風險不大于不轉換使用Lantus的風險。
3. 度普利尤單抗治療蕁麻疹臨床積極。賽諾菲/再生元度普利尤單抗(Dupixent)治療中重度慢性自發性蕁麻疹的第三階段試驗數據積極。與單獨使用抗組胺藥治療的患者相比,Dupixent顯著改善了患者瘙癢和蕁麻疹的情況。賽諾菲計劃明年提交Dupixent用于慢性自發性蕁麻疹治療的上市申請。Dupixent是一款IL-4/IL-13單抗,也是全球首個獲FDA及歐盟EMA批準治療中重度特應性皮炎的靶向生物制劑。
4. 馬賽替尼治療AD的Ⅲ期臨床積極。AB Science在AAIC-2021上公布口服酪氨酸激酶抑制劑馬賽替尼(masitinib)治療阿爾茨海默病(AD)的Ⅲ期臨床AB09004積極結果。治療24周后,與基線相比,馬賽替尼聯合標準治療組的ADAS-cog評分降低1.46(意味著認知能力得到改善),而安慰劑聯合標準治療組評分增加0.69。兩組之間的評分差距為-2.15 (97.5% CI,-3.48, -0.81, p=0.0003);馬賽替尼組的ADCS-ADL評分與基線相比提高1.01,安慰劑組評分降低0.81。
5. 額顳葉癡呆癥療法臨床積極。Alector公司sortilin靶向單抗AL001治療額顳葉癡呆(FTD)患者的Ⅱ期臨床結果積極。12個月隨訪結果顯示,AL001具有良好的安全性和耐受性,并且迅速恢復血漿和腦脊液(CSF)中的PGRN蛋白水平。與歷史對照組相比,接受AL001治療的患者臨床癥狀進展速度減緩47%,與溶酶體功能、補體激活、和神經元健康相關的生物標志物都趨于正常或保持穩定。目前,AL001已啟動關鍵性Ⅲ期臨床。
6. 羅氏眼科雙抗品種獲FDA優先審評。羅氏旗下基因泰克VEGF-A/Ang-2雙抗faricimab的生物制品許可申請(BLA)獲FDA授予優先審評資格,用于治療濕性(新生血管性)年齡相關性黃斑變性(AMD)和糖尿病性黃斑水腫(DME)。在針對濕性AMD患者的Ⅲ期(TENAYA和LUCERNE)試驗,以及針對DME患者的Ⅲ期(YOSEMITE和RHINE)試驗中,4項試驗均達到主要終點,顯示與每兩個月給藥一次的當前標準治療相比,每4個月給藥一次faricimab達到非劣效性標準的視力獲益。
7. 皮下RNAi療法獲突破性療法認定。FDA授予Arrowhead Pharmaceuticals公司 第二代皮下給藥的RNAi療法ARO-AAT(TAK-999)突破性療法認定,用于治療與α-1抗胰蛋白酶缺乏癥(AATD)相關的罕見遺傳性肝病。FDA此前已授予其孤兒藥資格和快速通道資格。ARO-AAT旨在敲除導致進展性肝病的突變α-1抗胰蛋白酶(Z-AAT)蛋白的產生。減少炎癥性Z-AAT蛋白的產生有望阻止肝病的進展,并可能允許肝臟再生和修復。Arrowhead已與武田達成共同開發這款藥物的合作協議。
醫藥熱點
1. 南京疫情源頭為俄羅斯入境航班。南京市疾控中心在南京第10場疫情防控新聞發布會上宣布,南京本輪疫情為同一個傳播鏈;源頭為俄羅斯CA910入境航班。據悉,參加CA910航班機艙清掃的保潔員工,由于防護洗脫不規范,導致個別保潔人員感染;而該公司的保潔員同時負責國際和國內航班的垃圾清運。本次疫情早期報告的機艙保潔員病例的病毒序列與7月10日俄羅斯入境的CA910航班報告的1例輸入病例的基因序列一致。
2. 醫保經辦服務將“六統一”。國家醫保局印發《關于優化醫保領域便民服務的意見》,以加快構建全國統一的醫保經辦管理服務體系。按照建設全國統一醫保信息平臺的目標,依托全國統一的技術體系和架構,加快推進各地醫保信息平臺落地應用,并與全國一體化政務服務平臺互聯互通。今年年底前,實現全國醫保經辦服務事項名稱、事項編碼、辦理材料、辦理時限、辦理環節、服務標準“六統一”。
3. 我國禁止開展小腿神經離斷瘦腿手術。個別醫療機構開展以“瘦腿”為目的“小腿神經離斷術”引起社會廣泛關注。為維護人民群眾生命健康權益,國家衛健委日前發布禁止開展“小腿神經離斷瘦腿手術”的通知,明確自印發之日起,禁止“小腿神經離斷瘦腿手術”應用于臨床。經專家論證,該手術缺乏科學依據和循證醫學證據,直接導致神經不可逆損傷和下肢運動功能障礙,存在嚴重安全性問題,有悖于醫學倫理原則。
4. 中國超重/肥胖醫學營養治療新指南發布。《中國超重/肥胖醫學營養治療指南(2021)》近日在北京正式發布。該指南在2016年版本的基礎上,旨在為臨床營養醫生提供一部高效、循證、實用的醫學營養減重方案。內容涉及健康中國人群在維持健康體重方面,更適宜傳統中國膳食宏量營養素組成的低脂肪、相對較高的碳水化合物膳食模式。以及,缺乏醫療指導、家庭關懷的患者更容易減重失敗等。
審評動向
寧波新灣的NB005膠囊(2個規格)、廣州如源的芪紅固本顆粒、華夏源細胞工程集團公司ELPIS人臍帶間充質干細胞注射液、正大天晴鹽酸安羅替尼膠囊(3個規格)、渤健生物的Diroximel Fumarate腸溶膠囊、三生國健的重組抗PD-1人源化單克隆抗體注射液、賽諾菲的Rilzabrutinib、。
2. FDA新藥獲批情況(北美07月28日)

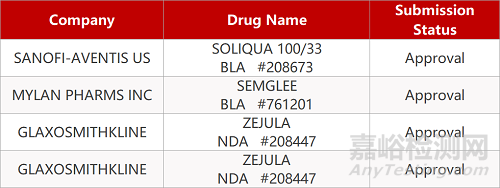

來源:藥研發


