您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-06-28 10:19
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
今日頭條
海正藥業創新降脂藥獲批上市。海正藥業首個創新藥海博麥布片(曾用名:海澤麥布片)獲國家藥監局批準上市,用于治療原發性高膽固醇血癥。海澤麥布作用機制是通過作用于小腸刷狀緣轉運蛋白NPC1LI抑制食物和腸肝循環膽固醇吸收,其作用靶點與默沙東開發的Zeta(依折麥布)相同。在一項關鍵III期試驗中,與安慰劑相比,該新藥主要療效指標LDL-C降低-14.6%(FAS集)和-16.0%(PPS集),不良反應與安慰劑無統計學差異,短期及長期服藥安全性良好。
國內藥訊
1.信達PD1抑制劑獲批治療肝細胞癌。信達生物PD-1療法信迪利單抗(CXSS2100009)獲國家藥監局批準新適應癥,聯合達攸同(貝伐珠單抗)一線治療不可切除或轉移性肝細胞癌。這是信迪利單抗在非霍奇金淋巴瘤、非鱗狀非小細胞肺癌(NSCLC)、鱗狀NSCLC之后獲批的第4項適應癥。在一項II/III期ORIENT-32研究中,與索拉非尼相比,這一組合顯著延長患者的PFS (中位值4.6個月vs2.8個月,p<0.0001)和OS,達優效性標準。
2.艾迪藥業治療艾滋病新藥獲批上市。艾迪藥業新型非核苷類逆轉錄酶抑制劑艾諾韋林片獲國家藥監局批準上市,用于治療HIV-1感染。在一項III期臨床中,艾諾韋林片與標準治療依非韋倫相比達非劣效性標準;而且在不良反應尤其是各類神經系統和精神類不良事件的發生率方面優于對照組。艾諾韋林曾是國家十三五重大新藥創制科技重大專項之一。
3.基石擬遞交RET抑制劑新適應癥上市申請。基石藥業宣布與Blueprint Medicines聯合開發的RET抑制劑普拉替尼在一線治療RET融合陽性非小細胞肺癌(NSCLC)的國際關鍵性Ⅰ/Ⅱ期試驗ARROW中獲積極結果。普拉替尼在中國患者中具有優越和持久的臨床抗腫瘤活性,整體安全可控,且沒有發現新的安全信號。基石藥業計劃近期提交這一新適應癥的上市申請。此前,普拉替尼已在中國獲批二線治療RET融合陽性NSCLC患者。
4.恒瑞SHR7280片治療前列腺癌獲批臨床。恒瑞醫藥1類新藥SHR7280片獲國家藥監局兩項臨床試驗默示許可,擬開發用于治療前列腺癌。SHR7280是一種口服小分子GnRH受體拮抗劑,可以阻斷內源性GnRH與GnRH受體的結合,抑制黃體生成素和卵泡刺激素等促性腺激素的合成和釋放,降低睪酮和雌二醇等性激素水平。目前FDA已批準Myovant Sciences與輝瑞聯合開發的Relugolix用于治療成人晚期前列腺癌;國內尚無口服同類產品獲批上市。
5.正大天晴三款抗腫瘤創新藥獲批臨床。正大天晴日前有多款抗腫瘤1類新藥獲國家藥監局臨床試驗默示許可,分別為CDC7抑制劑TQB3824、PARP抑制劑TQB3823以及未披露靶點的TQB3909。一項公布于AACR2021年會上的臨床前數據顯示,QB3824在CDC7過表達的實體瘤模型中顯示出高抗腫瘤功效,IC50為2.9 nM。目前國內僅有天晴和再鼎的CDC7抑制劑在研,再鼎尚處于臨床前研究中,預計今年啟動一項生物標志物的概念驗證性研究。
6.凌科創新藥LNK01003獲批臨床。凌科藥業1類新藥LNK01003獲國家藥監局臨床試驗默示許可,擬用于治療炎癥性腸炎。LNK01003是該公司自主研發的一款靶向激酶抑制劑,已在臨床前研究中展現出低系統暴露量和高腸道暴露量的優勢,潛在地避免了因系統性抑制免疫而帶來的毒性,是一款具有潛在藥效及安全性的創新候選藥物。
國際藥訊
1.托珠單抗治療新冠重癥在美獲EUA。FDA授予羅氏抗炎藥托珠單抗(Actemra/RoActemra)緊急使用授權(EUA),用于治療重癥COVID-19住院患者。托珠單抗是一款IL-6拮抗劑,已獲FDA批準用于治療中重度活動性類風濕性關節炎(RA)成人患者。在臨床研究RECOVERY中,tocilizumab提高了COVID-19住院患者的生存率,縮短了患者住院時間,并降低了患者對機械通氣的需求。而且,臨床中均未發現新的安全性信號。
2.禮來治療AD新藥獲突破性療法認定。禮來靶向β淀粉樣蛋白亞型N3pG的單抗藥物donanemab獲FDA授予突破性療法認定,用于治療阿爾茨海默病(AD)。在一項Ⅱ期臨床TRAILBLAZER-ALZ中,與安慰劑相比,donanemab治療組患者76周后的iADRS(整合阿爾茨海默病量表)評分降低幅度減少32%(p=0.04),達主要終點;有68%患者18個月后達到了PET檢測為陰性的水平。禮來計劃在今年晚些時候,使用加速批準通道,遞交donanemab的生物制品許可申請(BLA)。
3.渤健/衛材AD抗體療法獲突破性療法認定。渤健與衛材聯合開發的AD抗體療法lecanemab (BAN2401)獲FDA授予突破性療法認定。Lecanemab能與β淀粉樣蛋白的可溶性寡聚體特異性結合,旨在中和和清除阿爾茨海默病(AD)患者大腦中具有毒性的可溶性寡聚體。在一項Ⅱb期臨床Study 201中,lecanemab(10 mg/kg)能夠顯著降低患者大腦中的淀粉樣蛋白水平;在擴展試驗階段患者由安慰劑轉為lecanemab治療后也顯示出時間依賴性的淀粉樣蛋白水平的降低。
4.KRAS抑制劑獲FDA突破性療法認定。FDA授予Mirati公司開發的KRAS G12C抑制劑adagrasib突破性療法認定,用于治療攜帶KRAS G12C突變的經治非小細胞肺癌(NSCLC)患者。在一項注冊性Ⅰ/Ⅱ期臨床KRYSTAL-01中,adagrasib單藥治療(劑量為600 mg,每日兩次)在NSCLC患者中達到45%(23/51)的確認客觀緩解率;而且有70%(16/23)患者的腫瘤與基線相比縮小40%以上。預計今年下半年遞交NDA。再鼎擁有該新藥的大中華區開發權益。
5.羅氏創新眼部給藥系統獲FDA優先審評資格。FDA受理羅氏旗下基因泰克使用獨特端口遞送系統給藥的雷珠單抗療法(PDS)的生物制品許可申請(BLA),用于治療濕性年齡相關性黃斑變性(AMD)患者。FDA同時授予其優先審評資格,預計于10月23日前做出回復。一項關鍵性Ⅲ期臨床試驗表明,在超過98%的濕性AMD患者中,PDS能夠將治療間隔時間延長至6個月,并提供與每月注射雷珠單抗相當的視力結果。如果獲批,PDS將成為首個能夠定期補充給藥的眼部移植體療法。
6.BMS擬合作開發創新Tau蛋白抗體。百時美施貴寶(BMS)行使與Prothena公司此前達成的全球性神經科學研發合作協議中的選擇權,獲得臨床早期Tau蛋白抗體PRX005的美國開發權益。在阿爾茨海默病(AD)的小鼠模型中,PRX005可以降低動物的Tau蛋白病理特征,減緩動物認知能力的下降。根據協議,Prothena公司將獲得8000萬美元付款,并且有可能獲得高達17億美元的監管和商業化里程碑付款。
7.艾伯維收購BCMA雙特異性抗體療法。艾伯維宣布行使其獨家選擇權,收購Teneobio旗下子公司TeneoOne及其在研BCMA/CD3雙抗TNB-383B。一項Ⅰ期臨床中期結果顯示,在既往接受過至少3線治療的復發/難治性多發性骨髓瘤患者中,劑量≥40 mg時TNB-383B的ORR為79%,VGPR為63%,CR為29%。中位隨訪6.1個月(n=24)時,患者的中位DOR尚未達到。臨床中不良事件最常見的是細胞因子釋放綜合征(CRS)(52%)、疲乏(25%)和中性粒細胞減少(24%)。
醫藥熱點
1.山西財政支持基層醫衛體系建設。山西省財政廳日前發布消息,該省近年來人均基本公共衛生服務經費每年增加5元,2021年已達到79元。據悉,在支持鄉鎮衛生院改革運行機制方面,該省把鄉鎮衛生院全部確定為一類公益性事業單位,財政對鄉鎮衛生院的在編人員給予人員工資和公用經費足額保障。該廳還積極配合相關部門多舉措加強基層醫療衛生機構建設,不斷提高基層村醫待遇。
2.三級綜合醫院核醫學科2025年全覆蓋。國家多部門聯合發布《醫用同位素中長期發展規劃(2021—2035年)》。根據《規劃》,我國將健全核醫療產業發展政策,大力推廣核醫學科建設。2025年前,實現三級綜合醫院核醫學科全覆蓋;2035年前,在全國范圍內實現核醫學科“一縣一科”。《規劃》還明確,加快核醫學特色學科建設,培養一批技術人才和管理人才;優化人才評價體系,完善人才職業晉升標準。
審評動向
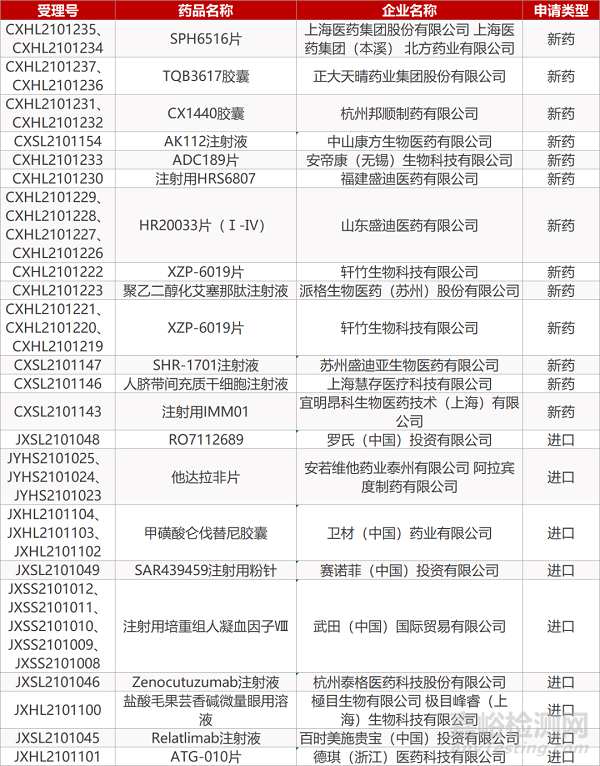
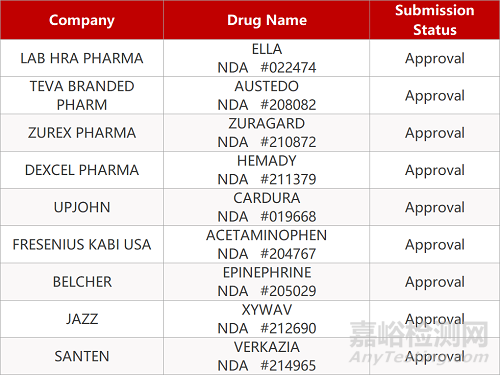

來源:藥研發


