您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-03-10 07:33
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
今日頭條
歌禮NASH新藥Ⅱ期臨床中美結果一樣好。歌禮旗下甘萊制藥與Sagimet公司聯合宣布,脂肪酸合成酶(FASN)抑制劑ASC40在治療非酒精性脂肪性肝炎(NASH)的Ⅱ期臨床的中國隊列中獲積極結果。與安慰劑相比,ASC40顯著降低肝臟脂肪含量(28.2%vs11.1%),其肝臟脂肪含量降低≥30%的患者比例達到50%,患者ALT指標也顯示出顯著改善。臨床中,該新藥耐受性良好,無嚴重不良事件發生。該隊列數據與在AASLD2020會議上發布的美國隊列數據結果一致。
國內藥訊
1.CDE針對境外已上市境內未上市化藥發布新規。CDE發布《境外已上市境內未上市化學藥品藥學研究與評價技術要求(試行)》,進一步指導企業開展藥品研發,加快境外已上市境內未上市化學藥品研發上市進程,自發布之日起施行。《技術要求》適用于境外已上市境內未上市的化藥,主要包括化學藥品3類;以及化學藥品5類(不適用于原研藥品已在境內上市的化學藥品5.2類)。與境外已上市境內未上市制劑關聯申報的原料藥也適用于該《技術要求》。
2.科倫舒尼替尼即將獲批。科倫藥業蘋果酸舒尼替尼膠囊4類仿制上市申請進入行政審批階段,有望近日獲批,成為該品種第三個獲批的仿制藥。舒尼替尼是輝瑞原研的一種多靶點受體酪氨酸激酶抑制劑,主要用于治療胃腸間質瘤、腎細胞癌和胰腺神經內分泌瘤成年患者,其2020年全球銷售額為8.19億美元。在中國公立醫療機構終端,舒尼替尼2019年銷售額接近4億元。
3.康寧杰瑞雙抗KN046美國Ⅱ期注冊臨床獲批。康寧杰瑞PD-L1/CTLA-4雙抗KN046的臨床試驗申請獲FDA批準,即將在美國開展用于治療胸腺癌的關鍵Ⅱ期注冊臨床。KN046已于2020年9月獲FDA授予用于治療胸腺上皮腫瘤的孤兒藥資格。在中國,KN046治療胸腺癌的Ⅱ期注冊臨床已于今年1月啟動。發布于WCLC 2020會議上的 一項Ⅰ期臨床數據顯示,KN046在胸腺上皮腫瘤患者中的疾病緩解率為75%,疾病控制率達100%。
4.海思科子公司轉讓在研TYK2產品。3月9日,海思科宣布,其控股三級子公司FronThera擬將其全資子公司FronThera U.S Holdings的全部股權轉讓給FL2021-001公司(美國風投公司Foresite Capital設立),FronThera公司最高有望獲得合計1.8億美元的轉讓款,其中包含首付款6,000萬美元及最高1.2億美元的里程碑款。此次交易,FL2021-001公司將獲得一款在研口服TYK2抑制劑(FTP-637),該新藥目前正在澳洲開展Ⅰ期臨床。
5.依生生物申請港交所IPO。依生生物在港交所遞交了IPO申請,聯席保薦人為摩根士丹利和海通國際。依生生物是一家創新生物醫藥公司,目前擁有3個處于臨床期的在研產品,包括皮卡狂犬病疫苗、皮卡YS-ON-001及皮卡YS-HBV-001;以及4種針對COVID-19、乙型肝炎病毒(HBV)、流感及癌癥的臨床前期在研產品。本次IPO募集資金將用于核心產品皮卡狂犬病疫苗及其他在研產品如皮卡重組新型冠狀病毒疫苗等的持續研發和商業化等。
國際藥訊
1.羅氏Evrysdi獲歐盟CHMP推薦批準。歐洲藥品管理局人用醫藥產品委員會(CHMP)推薦批準羅氏(Roche)SMN2基因剪接調節劑Evrysdi(risdiplam)上市,用于治療年齡≥2個月、臨床診斷為1型/2型/3型SMA或攜帶1-4個SMN2拷貝的5q型脊髓性肌萎縮癥(SMA)患者。Evrysdi是首個獲批用于這類患者的口服療法,也是首個可在家給藥的SMA療法。2020年8月,FDA已批準Evrysdi用于治療2個月及以上兒童和成人SMA患者,并頒發了一張罕見兒科疾病優先審查憑證(PRV)。
2.諾華SMA基因療法Zolgensma納入英國醫保。諾華制藥脊髓性肌萎縮癥(SMA)基因療法Zolgensma(onasemnogene abeparvovec)在英國獲批納入英國國家醫療服務體系(NHS)。Zolgensma是首個獲批治療SMA的基因療法,該療法每劑標價高達179萬英鎊(合247.25萬美元),患者可以通過英國NHS獲得該療法的治療機會。價格方面,英國NHS與諾華公司達成了一定的協議折扣,但具體數額并沒有對外公布。
3.吉利德艾滋病藥物Biktarvy長期療效數據積極。在第28屆逆轉錄病毒和機會感染會議上,吉利德公布HIV三合一復方新藥Biktarvy治療初治HIV-1患者的兩項III期臨床(1489和1490)的積極結果。數據顯示,98%開始使用Biktarvy治療的患者在四年的隨訪中達到并維持了無法檢測到病毒載量。在48周開放標簽擴展期,從含DTG三聯療法轉為Biktarvy治療的患者中,觀察到了高效和持久的病毒學抑制。研究中沒有發生治療引起的耐藥性。
4.艾滋病預防療法早期臨床結果積極。默沙東核苷逆轉錄酶易位抑制劑islatravir(MK-8591)在一項Ⅰ期臨床中獲積極結果。islatravir以皮下緩釋植入體(implant)的形式用藥,三種不同劑量的植入體均在12周內將藥物濃度維持在具有抗病毒效力的藥代動力學(PK)閾值水平以上。劑量56mg islatravir預計可將藥物濃度保持高于閾值一年以上。默沙東計劃啟動Ⅱ期臨床,進一步評估islatravir皮下植入體作為HIV長效暴露前預防(PrEP)療法的潛力。MK-8591有望只需一次用藥即可提供長達12個月的保護效力。
5.AI發現15種阿爾茨海默病潛在療法。麻省總醫院(MGH)和哈佛大學醫學院的聯合團隊基于人工智能對FDA已批準的80種藥物進行了篩選,評估它們作為阿爾茨海默病(AD)療法的潛力。他們發現了15種藥物具有治療AD的潛力,其中有5款藥物屬于JAK激酶抑制劑。這項研究發表在Nature Communications上。據悉,研究人員已計劃啟動一項臨床試驗,在出現輕度認知障礙或AD患者中檢驗JAK抑制劑baricitinib的效果。
6.羅氏阿替利珠單抗膀胱癌二線治療不夠好在美被撤回。羅氏與FDA達成共識,宣布在美國撤回PD-L1抑制劑Tecentriq(阿替利珠單抗)用于二線治療接受過含鉑化療的轉移性尿路上皮癌的適應癥批準。FDA在2016年5月基于IMvigor210研究隊列2的數據加速批準Tecentriq上市,用于二線治療局部晚期或轉移性尿路上皮癌。但在2017年5月更新的一項IMvigor211研究中,Tecentriq相比化療未能顯著改善患者總生存期(11.1vs10.6個月,HR=0.87)。此外,2020年5月公布的IMvigor130研究結果顯示,Tecentriq聯合化療相比化療改善了患者的mPFS(8.2vs6.3個月)。
醫藥熱點
1.芬蘭研發出鼻噴式新冠疫苗。芬蘭赫爾辛基大學8日宣布,該大學與東芬蘭大學合作開發出一款鼻噴式新冠疫苗。這是一款基于基因轉移技術研發而成的腺病毒載體新冠疫苗。研究團隊表示,由于新冠病毒可通過呼吸系統傳播,疫苗選擇鼻腔給藥,可能在人體中引起比肌肉注射更廣泛的免疫應答。該款疫苗將于幾個月內在芬蘭開展臨床試驗。
2.倫敦已有兩成新冠患者出現后遺癥。英國倫敦議會日前致函市長薩迪克·汗時透露,倫敦有五分之一的新冠肺炎患者會出現長期后遺癥,持續時間可長達12周甚至更久。初步研究顯示,年輕人以及患病時癥狀輕微無須入院的患者,較可能出現長期后遺癥。這些患者在感染三個月后,仍有呼吸困難、疲勞、抑郁、焦慮、脫發、腦霧等情況。倫敦目前已累計有近698405人確診感染新冠肺炎,這意味著全市有近14萬人曾經或正在受到病魔的長期困擾。
3.全國人大代表建議推進淋巴瘤專科建設。全國人大代表、齊魯制藥集團李燕為兩會帶來《關于推進我國淋巴瘤專科建設的建議》的提案,建議政府相關部門高度重視并支持醫院淋巴瘤專科建設,考慮成立全國管理指導機構,在政策引導、資金扶持等各方面,助力醫院建立從公眾宣傳到早篩、就診引導、規范治療再到康復的一體化全流程診療體系。
審評動向
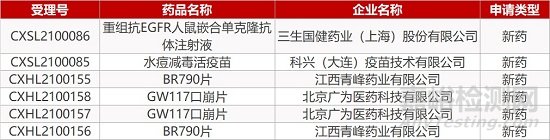
1. CDE新藥受理情況(03月09日)
申請臨床:
三生國健的重組抗EGFR人鼠嵌合單克隆抗體注射液、科興(大連)疫苗的水痘減毒活疫苗、青峰藥業的BR790片(2個規格)、北京廣為的GW117口崩片(2個規格)。
2. FDA新藥獲批情況(北美03月05日)

股市資訊
【戴維醫療】公司變更醫療器械生產許可證,在原有生產產品的基礎上增加了“醫用空氣壓縮機”。
【海正藥業】(1)公司的比卡魯胺片通過一致性評價。(2)徐曉艷女士申請辭去公司高級副總裁職務。
【透景生命】公司與全資子公司透景診斷的糞便樣本采集裝置及檢測架和糞便樣本采集裝置兩項產品取得專利證書。

來源:藥研發


