您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2020-11-18 11:22
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
「 本文共:15條資訊,閱讀時長約:3分鐘 」
今日頭條
康寧杰瑞皮下注射PD-L1抗體申報上市。康寧杰瑞與思路迪醫藥、先聲藥業合作開發的PD-L1恩沃利單抗注射液(KN035),在中國正式提交了生物制品上市許可申請,用于治療標準治療失敗的微衛星不穩定(MSI-H)/錯配修復功能缺陷(dMMR)晚期結直腸癌、胃癌及其他晚期實體瘤。KN035是康寧杰瑞自主研發的PD-L1單域抗體Fc融合蛋白注射液,由思路迪醫藥負責其腫瘤適應癥臨床開發,先聲藥業負責中國大陸的商業化推廣。KN035有望成為全球首款皮下注射PD-L1抑制劑。
國內藥訊
1.國為制藥骨化三醇軟膠囊即將獲批上市。國為制藥骨化三醇軟膠囊4類仿制上市申請獲CDE受理,目前狀態為在審評審批中。骨化三醇是維生素類藥物的TOP1品種,2019年在中國公立醫療機構終端的銷售額已突破20億元,目前該品種暫無企業獲批通過一致性評價。市場上國產的骨化三醇僅有正大制藥(青島)獲得批文,產品為軟膠囊,該企業也于今年7月遞交了一致性評價補充申請,目前正在審評審批中。
2.藥明巨諾將公布CAR-T療法Ⅱ期臨床結果。 藥明巨諾CAR-T療法瑞基奧侖賽注射液(relma-cel)治療復發/難治性大B細胞淋巴瘤(LBCL)的Ⅱ期臨床結果積極。在58例可評估療效的患者中,3個月的ORR為58.6%;截至2020年6月17日,最佳總緩解率為75.9%,完全緩解率(CR)為51.7%;中位隨訪時間為8.9個月,中位OS未達到,6個月DOR、PFS和OS分別為60.0%、54.2%和90.8%;高劑量組未觀察到療效改善。詳細結果將于ASH2020年會上展示。
3.和鉑醫藥干眼癥新藥Ⅱ期結果即將公布。和鉑醫藥合作品種創新型TNF受體1片段--特那西普(HBM9036)滴眼液,在治療中重度干眼癥的Ⅱ期臨床中獲積極結果。與安慰劑相比,特那西普顯著改善了患者角膜染色評分,且耐受性優異,舒適度與安慰劑相似。該結果與其合作伙伴HanAll公司的美國Ⅱ期臨床VELOS-1結果一致。詳細結果將在中華醫學會第25屆全國眼科學術大會上公布。
4.百濟神州HER2雙抗在中國獲批臨床。百濟神州引進品種注射用ZW25獲國家藥監局一項臨床試驗默示許可,擬開發用于單藥治療既往接受系統化療失敗的HER2陽性的局部晚期不可切除或轉移性膽道癌。ZW25(zanidatamab)是合作伙伴Zymeworks公司開發的一款HER2靶向雙抗,全球范圍內正處于Ⅱ期臨床階段。百濟神州擁有該新藥在亞洲(除日本外)、澳大利亞和新西蘭的獨家開發和商業化權利。
5.泰諾麥博生物破傷風毒素單抗在澳洲獲批臨床。泰諾麥博生物自主開發的抗破傷風毒素單抗藥物TNM002在澳洲獲批開展Ⅰ期臨床。該研究主要評估TNM002在健康受試者中的安全性、耐受性、藥代動力學和藥效學特征。據悉此次臨床研究是全球第一款抗破傷風毒素單抗藥物進入人體試驗,預計將于2021年8月完成。TNM002已在臨床前研究中顯示出特異性強、親和力高、中和破傷風毒素效價高的特點。
國際藥訊
1.Moderna新冠候選疫苗保護力達94.5%。Moderna公司新冠mRNA疫苗mRNA-1273在Ⅲ期臨床COVE的首次中期分析中達主要療效終點。由DSMB評估的結果顯示,mRNA-1273在保護出現癥狀的COVID-19疾病方面有效性為94.5%;疫苗耐受性良好,未報告任何顯著安全性問題。Moderna公司同日也宣布了mRNA-1273穩定性研究的最新數據。在2°~8°C標準冷藏溫度下,mRNA-1273能保持穩定30天;在-20° C 的冷凍溫度下可保持穩定長達6個月;在室溫下的穩定性可達到12個小時。
2.楊森啟動JNJ-78436735二聯新冠疫苗Ⅲ期臨床。楊森公司新冠疫苗Ad26.COV2.S(JNJ-78436735)啟動一項Ⅲ期臨床ENSEMBLE 2試驗。該試驗擬招募30,000名患有或不患有可能會導致COVID-19感染風險增加的合并癥的成年人,間隔57天接種JNJ-78436735評估二聯疫苗給藥方案的安全性和有效性。此前,該疫苗I/IIa期研究中期結果顯示,單劑量的JNJ-78436735幾乎在所有參與者中誘導了強烈的中和抗體反應,而且在各年齡組中引起的免疫反應是相似的。目前,該疫苗正在Ⅲ期ENSEMBLE試驗中評估單劑量預防COVID-19感染的效果。
3.Dicerna/羅氏RNAi療法治療乙肝最新結果積極。Dicerna Pharmaceuticals與羅氏聯合開發擬用于治療慢性乙肝病毒(HBV)感染的RNAi療法RG6346,在Ⅰ期臨床中獲長期療效結果。RG6346聯合核苷(酸)(NUC)抗病毒治療組在第112天(最后一次RNAi給藥后1個月)HBsAg較基線平均降低大于1.0 log10 IU/mL的患者比例達到92%(11/12),有58%患者的HBsAg絕對水平也達到低于100 IU/mL。在第448天(最后一次RNAi給藥后1年),聯合治療組患者HBsAg水平相對基線平均降低1.40 log10 IU/mL(n=3),其中1例患者HBsAg水平相對基線降低大于2.0 log10 IU/mL。
4.索馬魯肽組合療法公布最新臨床試驗結果。諾和諾德GLP-1受體激動劑索馬魯肽與吉利德在研法尼醇X受體(FXR)激動劑cilofexor和/或乙酰輔酶A羧化酶(ACC)抑制劑firsocostat聯用,治療非酒精性脂肪性肝炎(NASH)的概念驗證Ⅱ期臨床達主要終點。對與肝臟健康相關的生物標志物的探索性事后分析顯示,聯合治療組24周后患者的肝臟脂肪變性(MRI-PDFF)和肝損傷(ALT)與索馬魯肽單藥治療相比發生統計學顯著改善。兩家公司同時也公布這一組合在NASH小鼠模型中的臨床前數據。
5.Kiniksa創新療法獲FDA突破性療法認定。FDA授予Kiniksa公司靶向抗制瘤素M受體-β(OSMRβ)單抗藥物vixarelimab突破性療法認定,用于治療與結節性癢疹相關的瘙癢。這一突破性療法認定是基于vixarelimab治療結節性癢疹的Ⅱa期臨床試驗的數據。該試驗達到了其主要療效終點:與安慰劑組相比,vixarelimab組在接受治療第8周時每周平均最嚴重瘙癢數字評定量表(WI-NRS)評分與對照組相比出現具有臨床意義且統計學顯著的降低。
6.禮來合作品種RNAi基因療法獲FDA批準臨床。FDA批準Dicerna與禮來合作開發的RNAi基因療法LY3561774提交的新藥臨床試驗申請IND。該授權的通過觸發了禮來向Dicerna支付1000萬美元的里程碑付款,同時,后期禮來將開展有關LY3561774的I期臨床試驗。根據前期規劃,該試驗預計在2020年底之前進行患者招募,主要用于治療一種未知原因的心血管代謝性疾病。這是Dicerna與禮來合作的第一個臨床階段候選藥物。
醫藥熱點
1.醫院互聯網影響力排行榜發布。中國社科院健康業發展研究中心聯合好大夫在線,發布了2020中國醫院互聯網影響力排行榜。從上榜次數來看,北京協和醫院、解放軍總醫院、四川大學華西醫院居前三名;從在線問診服務量的角度看,上海交通大學醫學院附屬第九人民醫院、北京協和醫院、復旦大學附屬華山醫院排名前三;從線下醫院的就診滿意度看,患者在好大夫平臺反饋的結果顯示,北京協和醫院、北京大學第一醫院、解放軍總醫院分列前三。
2.恒瑞位居藥品專利攻防戰實力排行榜首。最高人民法院對外發布《關于審理涉藥品上市審評審批專利民事案件適用法律若干問題的規定》,公開征求修改意見。近年來,國內各大創新藥企不僅加強自身專利布局,而且為搶先機,紛紛對原研藥企的專利發起了挑戰。通過國家知識產權局專利復審和無效官網上公開數據顯示,擁有創新藥數量TOP10的國內藥企從2007年就已經開始對原研藥企的專利發起了各種口審和復審的請求,其中恒瑞、天晴、石藥位居前三。
3.“健康”成為政績考核法定內容。近日,深圳市第六屆人民代表大會常務委員會第四十五次會議通過《深圳經濟特區健康條例》。該《條例》將健康深圳建設納入政府績效考核指標體系,將健康影響評估和健康政策實施情況等作為市政府各部門考核內容;將法定傳染病發病率、主要慢性病規范管理率、分級診療及主要居民健康狀況指標改善情況等作為各區政府的考核內容。《條例》自明年1月1日起施行。
股市資訊
【海辰藥業】公司對外投資收購的NMS集團下屬子公司Nerviano Medical Sciences S.r.l.于近日收到國家藥品監督管理局(NMPA)簽發的《藥物臨床試驗批準通知書》。藥品名稱:NMS-03305293膠囊。
【恒瑞醫藥】公司近日收到國家藥監局核準簽發的關于SHR6390片,HR021611和HR091506片的《藥物臨床試驗批準通知書》,并將于近期開展臨床試驗。
【魯抗醫藥】控股子公司山東魯抗醫藥集團賽特有限責任公司收到國家藥監局核發的鹽酸氨溴索注射液《藥品注冊證書》。
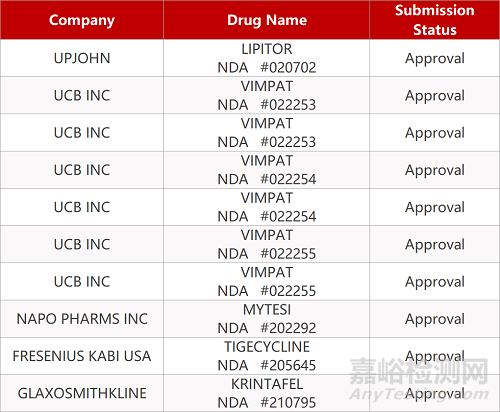
審評動向

- The End -

來源:藥研發


