您當前的位置:檢測資訊 > 實驗管理
嘉峪檢測網 2020-09-20 16:54
隨著生命科學技術的進步,PCR成為當下“最熱”的檢測技術之一。許多生物實驗室都會進行PCR實驗,正確掌握PCR的原理及檢測方法對我們的科研將是如虎添翼。
PCR (polymerase chain reaction)聚合酶鏈式反應,又稱體外DNA擴增技術,在1985年由美國Cetus公司的Kary Mullis首創,可以將微量目的DNA片段擴增一百萬倍以上。Kary Mullis本人因此獲1993年諾貝爾化學獎。
優點:敏感度高、特異性強、產率高、重復性好以及快速簡便等,廣泛應用于微生物學、考古學、 法醫學及體育等領域,并已普及到許多普通實驗室, 大大簡化了傳統的分子克隆技術,從而比較容易地 對目的基因進行分析、鑒定。
PCR的原理
用于擴增位于兩段已知序列之間的DNA片段,類似于天然DNA的復制過程。以擬擴增的DNA分子為模板,以一對分別與模板5'末端和3'末端互補的寡核苷酸片段為引物, 在DNA聚合酶的作用下,按照半保留復制的機制沿著模板鏈延伸直至完成新的DNA合成,重復這一過 程,即可使目的DNA片段得到擴增。
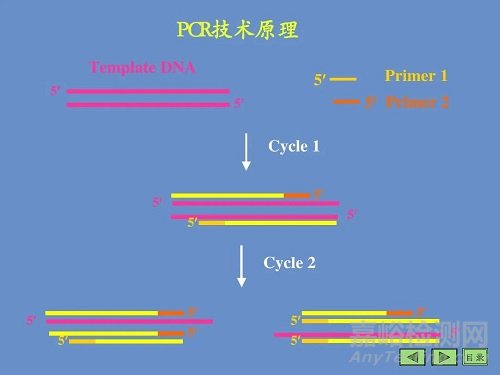
PCR基本反應步驟
擴增的特異性取決于引物與模板DNA的特易結合,基本反應步驟分三步:
1、變性(Denaturation):
加熱使模板DNA雙鏈間的氫鍵斷裂而形成兩條單鏈。
94°C 30〃
2、退火(復性)(Annealling):
突然降溫后模板DNA與引物按堿基配對原則互補結合,也存在兩條模板鏈之間的結合,但由于引物的高濃度,結構簡單的特點,主要的結合發生在模板與引物之間。
55°C 30〃
3.延伸(Extension):
將反應溫度調節到酶的最適溫度,在DNA聚合 酶、4種dNTPs及鎂離子等存在的條件下,以引物的3'端開始,結合單核昔酸,形成與模板鏈互補的新DNA鏈。
72°C 1〃
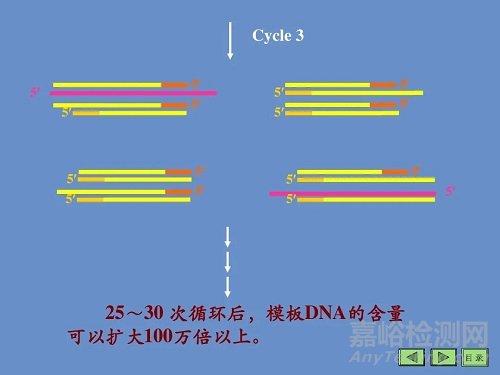
上述3步為一個循環,每經過一個循環,樣本 中的DNA量應該增加一倍,新形成的鏈又可成為新一輪循環的模板,經過25?40個循環后DNA可擴增106 ?109 倍。
PCR擴增的特異性是由一對寡核苷酸引物所決定的。
反應初期,原來的DNA擔負起使模板的作用,隨著循環次數的遞增,由引物介導延伸的 片段急劇增多而成為主要模板,最終的擴增產物是介于兩種引物5'端之間的DNA片段。
PCR的成分和作用
1、緩沖液:
10~50 mM Tris- Cl (pH8.4)
維持Taq酶作用環境的偏堿性
25~50 mM KCl
促進引物退火,>50 mM會抑制Taq酶的活性。
100μg/ml牛血清白蛋白(BSA)
對酶有一定的保護性,如質量不好將起相反的作用,建議使用乙酰化的BSA。明膠、Tween-20、二硫蘇糖醇(DTT)也有類似作用。
2、MgCl2:
L5~2e0 mM
Taq酶具有Mg2+依賴性,顯著影響反應 的特異性和擴增片段的產量,過量能增加非特異擴增并影響產率,過低則酶活性顯著下降。
3、dNTPs :
dATP、dGTP、dCTP、dTTP—底物
0.02 ?0.2 mM
dNTPs可與Mg2+結合,應注意Mg2+濃 度與dNTPs濃度之間的關系,Mg2+濃度比 dNTPs 濃度高 0.2~2.5 mM。
過高:加快反應速度,還可增加堿基的錯誤摻入率和室驗成本。
過低:反應速度下降,可提高實驗的精確性。
4、引物(Primer-P):
預擴增核酸片段兩端的已知序列,決定特異性。0.2~1 μM
偏高:非特異產物擴增及錯配,增加引物之間形成引物二聚體,產量降低。
偏低:產量降低。
5、Taq DNA聚合酶:
耐高熱
0.5~5 U/100μL
1U/25~50μL
偏高:引物非特異產物的擴增。
偏低:產物量降低。
6、模板DNA (Template):
最低102~105 bpDNA片段,實際用量遠遠 超過此量,用量需在實驗中摸索。1~5μL。
過高:非特異產物增加
過低:產量降低
7、水:
去離子水,補足整個反應體積。
PCR反應條件優化
1、變性溫度和時間:
保證模板DNA解鏈完全是保證整個PCR擴增成功的關鍵。
加熱90~95°C, 30~60s,再復雜的DNA 分子也可變性為單鏈。根據模板DNA復雜程度,可以調整變性溫度和時間。一般情況下選擇90°C 30〃,可使各種復雜的DNA分子完全變性。
溫度過高或高溫持續時間過長,可對Taq酶活性和dNTP分子造成損害。
2、復性溫度和時間:
PCR擴增特異性取決于復性過程中引物與模板的結合。
復性溫度的選擇,可根據引物的長度和G+C含 量確定,長度在15~25 bp之間時,復性溫度Tm=4(G+C)+2(A+T)計算得到,一般位于40~600°C,30~60s。
復性溫度越高,產物特異性越高。復性溫度越低,產物特異性越低。
一般情況下選擇55°C 30〃足以使引物與模板 之間完全結合。
3、延伸溫度和時間:
一般位于Taq酶最適作用溫度70~75°C之間。引物小于16個核苷酸時,過高的延伸溫度不利于引物與模板的結合,可以緩慢升溫到70~75°C。
延伸反應時間,可根據待擴增片段的長度而定,<1Kb, 1分鐘足夠;>1Kb需加長延伸時間,10Kb片段延伸時間可達15分鐘。
延伸時間過長可出現非特異擴增,常用72°C 1〃。
4、循環數:
其他參數選定后,PCR循環次數主要取決于模板DNA的濃度。
理論上說20?25次循環后,PCR產物的積累即可達到最大值,實際操作中由于每步反應的產率不可能達到100%,因此不管模板濃度是多少,20~30次是比較合理的循環次數。循環次數越多,非特異擴增增加。

來源:Internet


