您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2020-09-12 11:15
本文將重點介紹并分析檢漏技術的應用,高壓放電密封性檢測和激光密封性檢測的原理及優勢——內容覆蓋 3 種檢漏精度驗證方式的優勢與劣勢,以及激光檢漏泄漏率速率。
國家藥品監督管理局于2019年10月15日發布了《化學藥品注射劑仿制藥質量和療效一致性評價技術要求(征求意見稿)》和《已上市化學藥品注射劑仿制藥質量和療效一致性評價申報資料要求(征求意見稿)》兩項重磅政策。《化學藥品注射劑仿制藥質量和療效一致性評價技術要求(征求意見稿)》第三章在生產工藝滅菌/無菌工藝驗證方面作出了明確的規定,提出“包裝系統密封性驗證,方法需經適當的驗證”,尤其對于無菌灌裝產品,政策明確要求至少開展“直接接觸無菌物料和產品的容器密封系統的滅菌驗證”等多項驗證,并提交驗證報告,并且再次強調“包裝系統密封性驗證,方法需經適當的驗證”。
滅菌/無菌工藝驗證
對于終端滅菌藥品,至少進行并提交以下驗證報告:
● 藥品終端滅菌工藝驗證;
● 直接接觸藥品的內包材的除熱原驗證或供應商出具的相關證明資料;
● 包裝系統密封性驗證,方法需經適當的驗證;
● 保持時間(含化學和微生物)驗證。
對于無菌灌裝產品,至少進行并提交以下驗證報告:
● 除菌工藝的細菌截留驗證;
● 如不采用過濾除菌而采用其他方法滅菌,提供料液/大包裝藥的滅菌驗證;
● 直接接觸無菌物料和產品的容器密封系統的滅菌驗證;
● 直接接觸產品內包材的除熱原驗證或供應商出具的相關證明資料;
● 無菌工藝模擬試驗驗證,并明確試驗失敗后需要采取的措施;
● 包裝系統密封性驗證,方法需經適當的驗證;
● 保持時間(含化學和微生物)驗證。
隨著固體制劑一致性評價的開展,注射劑一致性評價也緊隨其后。無菌藥品生產中有許多因素可導致藥品包裝容器密封性缺失,從而影響藥品質量。生產質量管理規范(GMP)中明確規定無菌藥品包裝容器的密封性應經過驗證,以避免產品遭受污染。微生物挑戰法、色水法、飽和鹽水法等傳統驗證方法,由于檢測效率低、精度不高、驗證過程可能直接污染藥品等諸多原因,在大規模應用時受到了制約。
高壓放電法
就基本原理而言,高壓放電法是一種基于有無漏孔下容抗特性差異的一種密封完整性檢測方法,在容器上加載高壓電,有漏孔時電流會顯著增大,此時可以通過設置閾值來判斷容器密封性。
高壓放電法具有無損、可靠的特點,獲得《美國藥典》(USP)1207和FDA的認可。這項檢測方法中,要求容器中的藥液電導率達到5?μS/cm,并且藥品為非易燃易爆液體,適用于安瓿水針、西林瓶水針、口服液、三合一及軟袋等產品的密封完整性檢查。安瓿高壓放電檢漏原理如圖1所示。

圖1 安瓿高壓放電檢漏原理示意圖
驗證方法
(1)替代法
將管或移液管插入包裝從而制成陽性對照,這一方法成本相對較低并且操作簡單,但在多數情況下,管或移液管與包裝周圍所客觀存在的縫隙,無法將其完全密封,就會形成假陽性對照。在人工操作過程中,也會存在因操作不當引起堵塞缺陷的風險。替代法示意如圖2所示。

圖2 替代法示意圖
(2)對比法
與色水法、微生物挑戰法對比驗證,這一方法適用于批量對比驗證,成本相對較低。其中,色水法對比驗證相比微生物挑戰法對比驗證周期短。此外,對比驗證方法主要驗證高壓放電法是否優于色水法,無法驗證高壓放電法的檢測精度。
(3)微孔驗證法
激光在包裝上鉆孔(如圖3所示)并驗證微孔當徑大小,從而形成陽性對照。在驗證時,可直接對陽性對照樣品與陰性對照樣品進行高壓放電法測試。這一方法能夠驗證密封容器完整性,具備查找可能出現缺陷的能力,以及可以較準確地驗證密封容器完整性方法的檢測最小微孔。此種方法的缺點在于:成本高,驗證精度受制于激光鉆孔與檢測手段的最大能力。

圖3 激光在包裝上鉆孔
高壓放電法驗證包裝容器密封完整性

激光檢測法

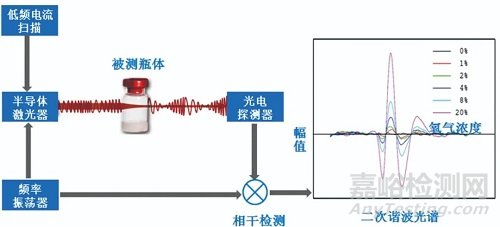
圖5 TDLAS激光檢測技術原理圖

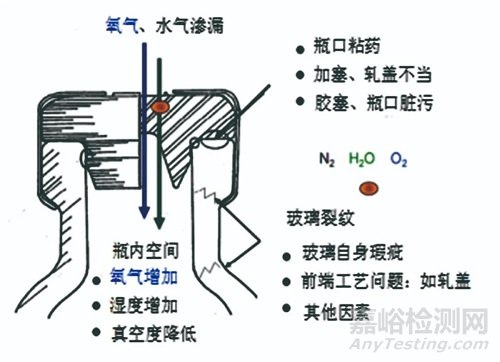
圖6 多種因素致使瓶體內氧氣濃度發生變化
容器的泄漏速率

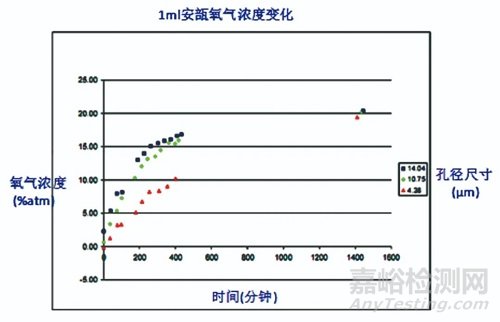
圖7 1?atm氮氣下1?mL安瓿不同漏孔泄漏速率
激光頂空分析法驗證包裝容器密封完整性


圖8 激光檢測與視覺檢測相融合
結論


來源:制藥業


