您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2020-07-31 10:48
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
「本文共:15條資訊,閱讀時長約:3分鐘 」
今日頭條
國內藥訊
1.中國生物制藥鹽酸伊達比星首家通過一致性評價。中國生物制藥注射用鹽酸伊達比星(安必健)獲國家藥監局批準上市,用于治療急性髓系白血病(AML),并視同通過一致性評價。伊達比星是一款抗腫瘤抗生素,具有藥物脂溶性和抗腫瘤活性較高的特點,是國內外指南一致推薦的 AML基石治療藥物。安必健是國內同品種首個通過一致性評價的產品。
2.歌禮1類丙肝新藥拉維達韋即將獲批。7月29日, 歌禮制藥新一代NS5A抑制劑拉維達韋上市申請進入行政審批階段,有望近期獲批,用于治療慢性丙肝。拉維達韋是歌禮開發的第2款丙肝創新藥。在一項涉及424例非肝硬化的GT1 HCV感染初治成人患者的II/III期臨床中,應用拉維達韋聯合利托那韋強化的達諾瑞韋和利巴韋林治療12周后,治愈率(SVR12)高達99%,且療效不受基線NS5A耐藥相關替換影響,同時具有良好的耐受性。
3.基石藥業阿泊替尼獲優先審評。7月28日,CDE按照優先審評范圍“(五)符合附條件批準的藥品”將基石藥業合作品種阿泊替尼片上市申請正式納入優先審評審批程序。阿泊替尼是由Blueprint公司開發的一款KIT/PDGFRA抑制劑,于2020年1月獲FDA批準用于治療攜帶PDGFRA 外顯子18突變(包括PDGFRA D842V)的晚期胃腸間質瘤成人患者,是全球首款治療這類患者的精準靶向藥物。基石藥業擁有阿泊替尼在大中華區的獨家開發和商業化授權。
4.嘉和生物PD-1單抗擬納入優先審評。嘉和生物的PD-1單抗杰諾單抗(geptanolimab, GB226)注射液上市申請獲CDE納入擬優先審評公示名單,理由是“符合附條件批準”。杰諾單抗申請上市的適應癥為治療外周T細胞淋巴瘤(PTCL),這是首個在中國境內申請這一適應癥的PD-1單抗。目前,杰諾單抗正在中國開展多項臨床試驗,涉及外周T細胞淋巴瘤、原發縱隔大B細胞淋巴瘤、宮頸癌、非小細胞肺癌等多種適應癥。
5.再生之城1類創新CAR-T療法臨床申請獲受理。再生之城抗HIV-1嵌合抗原受體T細胞(CAR-T)注射液臨床申請獲CDE受理。據悉,該療法由中山大學張輝教授團隊開發,能有效誘導感染HIV-1的CD4 T淋巴細胞的細胞溶解的嵌合抗原受體T細胞(VC-CAR-T),旨在重建可靠的免疫監測,根除重新激活的HIV-1感染細胞,具有功能性治愈艾滋病的潛能。該療法的臨床前相關研究結果已于2016年在Journal of Virology期刊上發表。
6.萬泰生物和賽諾菲達成輪狀病毒疫苗合作。7月30日,萬泰滄海與賽諾菲就萬泰滄海的新型輪狀病毒疫苗在全球開發、生產及商業化達成獨家許可協議。該疫苗是廈門大學與萬泰滄海聯合開發的一款重組蛋白疫苗,主要用于預防A型輪狀病毒引起的兒童腹瀉。根據協議,萬泰滄海公司將獲1000萬美元預付款,5800萬美元的里程碑付款以及商業化后疫苗凈銷售額1%或2%的許可費。同時萬泰滄海有權從賽諾菲獲得上述授權的再許可,以便在中國開發輪狀病毒疫苗。
國際藥訊
1.BMS重新遞交CAR-T細胞療法上市申請。百時美施貴寶(BMS)和bluebird bio公司聯合宣布,已向FDA提交雙方聯合開發的CAR-T療法idecabtagene vicleucel(ide-cel,bb2121)的上市申請(BLA)。這是一款靶向B細胞成熟抗原(BCMA)的嵌合抗原受體(CAR)T細胞免疫療法,用于治療復發/難治性多發性骨髓瘤成人患者。本次提交提供了化學、生產和控制(CMC)模塊的更多詳細信息,以解決2020年3月初始BLA提交后FDA在2020年5月提出的未滿足的監管要求。
2.艾伯維CGRP受體拮抗劑達到Ⅲ期終點。艾伯維在研口服CGRP受體拮抗劑atogepant在預防偏頭痛的Ⅲ期臨床ADVANCE中達主要終點。atogepant所有劑量組(10mg/30mg/60mg)患者偏頭痛平均天數降低3.69/3.86/4.2天,顯著優于安慰劑組的2.48天(p<0.0001);每月平均偏頭痛發作日降低50%的患者比例分別為55.6%/58.7%/60.8%,而安慰劑組這一數值為29.0%(p<0.0001)。詳細數據將在醫學大會/期刊上發布。艾伯維計劃近期向FDA或其他國家提交其監管申請。
3.默沙東HIF-2α抑制劑獲FDA突破性療法認定。FDA授予默沙東缺氧誘導因子-2α(HIF-2α)抑制劑MK-6482突破性療法認定,用于治療von Hippel-Lindau(VHL)疾病相關的腎細胞癌(RCC)患者,這些患者攜帶小于3厘米大小的非轉移性RCC腫瘤。FDA還授予MK-6482治療VHL疾病的孤兒藥資格。在2020年美國臨床腫瘤學會年會上公布的一項Ⅱ期臨床結果表明,MK-6482在VHL相關透明細胞RCC患者中達到27.9%的總緩解率,86.9%的患者靶標病變縮小。
4.Moderna新冠疫苗動物實驗數據發表。Moderna公司mRNA新冠疫苗mRNA-1273的動物實驗結果發表于《新英格蘭醫學雜志》上。三組、每組8只恒河猴分別兩次注射10 μg或100 μg的mRNA-1273或安慰劑。結果顯示,疫苗組恒河猴血液中產生的中和抗體均高于COVID-19康復者的抗體水平,疫苗同時激活了T細胞免疫反應。在暴露于病毒兩天后的恒河猴中,疫苗組各有7只恒河猴的肺部未檢測到病毒復制,而安慰劑組8只恒河猴肺部均有病毒復制;此外,100 μg疫苗組的8只恒河猴鼻子中均沒有檢測到病毒。mRNA-1273顯示出快速控制恒河猴上、下呼吸道中新冠病毒的潛力。
5.優時比與羅氏達成阿爾茨海默病新藥合作。優時比公司與羅氏及其旗下基因泰克公司達成一項獨家許可協議,用于其阿爾茨海默病(AD)在研重組Tau蛋白靶向單抗UCB0107在全球的開發與商業化。根據協議,優時比將獲得1.2億美元的前期付款,總額可能高達20億美元的開發、銷售里程碑付款和特許權使用費等;優時比將負責在AD中進行概念性驗證研究,一旦獲得該研究結果后,基因泰克有權選擇繼續開發或將全部權利歸還給優時比。該交易仍需獲得反托拉斯批準。
醫藥熱點
1.第三批國家藥品集采啟動。上海陽光醫藥采購網發布《全國藥品集中采購文件》,第三批集采涉及56個品種,將于8月20日在上海拉開帷幕。根據文件,符合資格的申報企業大于等于11家時,最多允許8家中選。而在相對應的采購周期方面,實際中選企業數為1家或2家的,采購周期原則上為1年;中選企業數為3家的,采購周期原則上為2年;中選企業數為4家及以上的,采購周期原則上為3年。其中,阿扎胞苷注射劑、莫西沙星氯化鈉注射劑、左乙拉西坦注射用濃溶液本輪采購周期原則上為1年。
2.世衛組織認為群體免疫將導致更多人死亡。據美國CNBC報道,當地時間7月29日,世衛組織官員Mike Ryan稱不要試圖通過讓新冠病毒在社區內迅速傳播來實現所謂的群體免疫,這會讓醫院不堪重負,導致更多人死亡。大多數科學家認為60%至80%的人口需要接種疫苗或擁有天然抗體才能實現群體免疫。但Mike Ryan認為目前離這個數字還差得很遠,呼吁大家做好防護措施,保護自己,保護他人。
3.休艙的武漢客廳方艙醫院徹底“關張大吉”。7月29日,武漢客廳方艙醫院開始拆除,并逐步恢復原有業態,預計工作需要兩三天完成。該方艙醫院是武漢首批方艙醫院之一,僅用三天建成。3月8日休艙后,武漢客廳又先后8次對方艙內外進行全面消殺,同時維護及保潔設施設備。接下來,武漢客廳會展中心將恢復其原有場館功能,全面承接各類展會、文藝演出等活動,助力武漢會展行業全面復工復產,推動民生與經濟的全面復蘇。
股市資訊
【康緣藥業】公司收到國家藥監局核發的澤瀉降脂膠囊《藥物臨床試驗批準通知書》。
【健友股份】(1)2020年半年度實現營業收入13.96億元(+18.64%),實現歸母凈利潤4.08億元(+41.24%),實現扣非歸母凈利潤4.04億元(+44.30%)。(2)股東TANG YONGQUN通過上交所累計減持健友轉債50.31萬張,占發行總量的10%。
【衛光生物】公司擬以自有資金出資1.00億元在深圳光明區投資設立全資子公司。
審評動向
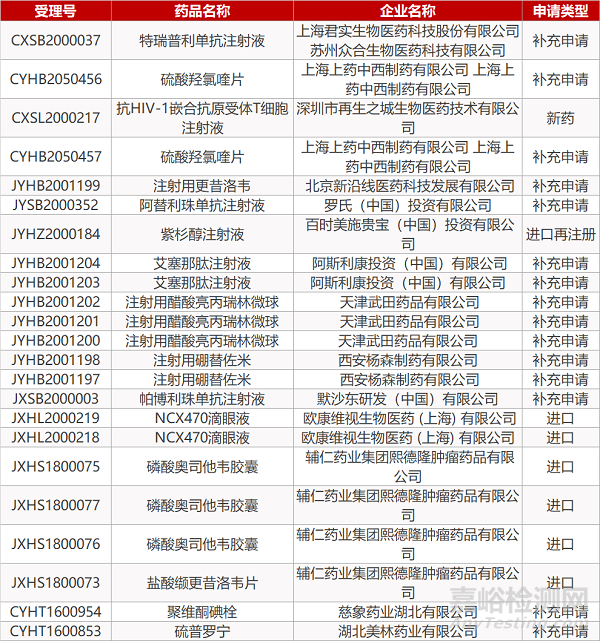
1. CDE最新受理情況(07月30日)

- The End -

來源:藥研發


