您當(dāng)前的位置:檢測(cè)資訊 > 科研開(kāi)發(fā)
嘉峪檢測(cè)網(wǎng) 2020-06-01 11:09
1、摘要
強(qiáng)制降解試驗(yàn)屬于藥物穩(wěn)定性研究?jī)?nèi)容之一,也是藥物開(kāi)發(fā)研究的一部分,有助于揭示藥物的穩(wěn)定特性和可能降解途徑,對(duì)于分析方法的開(kāi)發(fā)和驗(yàn)證也具有重要意義。本文是筆者對(duì)原料藥強(qiáng)制降解試驗(yàn)理論的總結(jié),供廣大讀者在工作閑暇之處討論,不足之處還望理解。
2、原料藥強(qiáng)制降解試驗(yàn)的目的
強(qiáng)制降解試驗(yàn)是指將原料藥置于劇烈的試驗(yàn)條件下,考察其穩(wěn)定性的一系列試驗(yàn)。試驗(yàn)?zāi)康闹饕校阂皇峭ㄟ^(guò)試驗(yàn)了解該原料藥內(nèi)在的穩(wěn)定特性及其降解途徑與降解產(chǎn)物。例如,通過(guò)酸降解試驗(yàn),可以了解所考察的藥品在酸性條件下是否穩(wěn)定;如果不穩(wěn)定,大致在何種條件下不穩(wěn)定,該藥品又是通過(guò)何種降解途徑得到何種降解產(chǎn)物;二是為包裝材料選擇提供信息;三是對(duì)原料藥有關(guān)物質(zhì)分析方法進(jìn)行專屬性驗(yàn)證;四是為儲(chǔ)存條件提供信息。
典型的強(qiáng)制降解主要包括四種機(jī)制:高溫、水解、氧化和光降解。
堿降解試驗(yàn)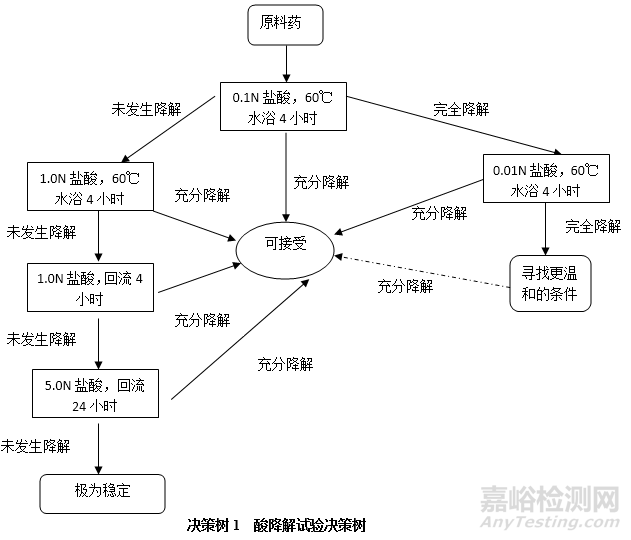

氧化降解試驗(yàn)
熱降解試驗(yàn)
熱降解試驗(yàn)一般情況下是在優(yōu)先進(jìn)行酸堿降解試驗(yàn)的水浴加熱條件,根據(jù)試驗(yàn)結(jié)果逐步提高加熱溫度。其是符合阿倫尼斯方程的,即降解速率隨著溫度的升高而加快。通常還可結(jié)合高濕度條件進(jìn)行。可按決策樹(shù)4進(jìn)行試驗(yàn)。

光降解試驗(yàn)

3、降解試驗(yàn)樣品設(shè)計(jì)
在進(jìn)行強(qiáng)制降解試驗(yàn)時(shí),所需的樣品濃度應(yīng)至少為1.0mg/ml。對(duì)于水溶性較差的原料藥可以采用少量甲醇混合溶解的方式達(dá)到預(yù)期樣品濃度。而原料藥經(jīng)過(guò)酸、堿、氧化降解破壞后,一般含有較高的殘留的反應(yīng)劑,應(yīng)該對(duì)破壞后的樣品采用中和法或稀釋法進(jìn)行前處理,避免損壞儀器和色譜柱。
一般來(lái)說(shuō)一種降解條件需要制備4份樣品進(jìn)行對(duì)比試驗(yàn):常規(guī)條件的空白溶液、常規(guī)條件的供試品溶液、降解條件下的空白溶液和降解條件下的供試品溶液。在進(jìn)行降解試驗(yàn)過(guò)程中,間隔取樣可以識(shí)別一級(jí)產(chǎn)物和二級(jí)產(chǎn)物。
4、降解試驗(yàn)終點(diǎn)
每個(gè)降解條件都應(yīng)規(guī)定一個(gè)合格的反應(yīng)終點(diǎn),從而達(dá)到最優(yōu)破壞水平,也就是決策樹(shù)中所說(shuō)的充分降解。對(duì)于原料藥的強(qiáng)制降解試驗(yàn),一般以主成分降解5%~20%為宜;對(duì)于要求含量為標(biāo)示量的90.0%~110.0%的原料藥,破壞程度應(yīng)不超過(guò)主成分的10%。
5、降解試驗(yàn)結(jié)果判定
對(duì)于降解破壞后的含量大于0.1%的未知雜質(zhì),應(yīng)該對(duì)于進(jìn)行結(jié)構(gòu)確證。并且所用分析方法應(yīng)該使含量大于0.1%的未知雜質(zhì)的分離度符合要求或者滿足定性要求。采用DAD或PDA檢測(cè)器的峰純度功能可以判斷主成分是否掩蓋了降解破壞后生產(chǎn)的雜質(zhì)。同時(shí)經(jīng)各降解條件破壞后的樣品應(yīng)該達(dá)到質(zhì)量守恒,對(duì)于潛在損失、非紫外吸收、強(qiáng)極性雜質(zhì)和極弱極性雜質(zhì)都應(yīng)該被考慮。
6、仿制藥和創(chuàng)新藥的強(qiáng)制降解試驗(yàn)
對(duì)于創(chuàng)新藥應(yīng)該早期開(kāi)展強(qiáng)制降解試驗(yàn),設(shè)計(jì)比較全面的強(qiáng)制降解試驗(yàn),充分了解穩(wěn)定性特征,為制劑處方、工藝的設(shè)計(jì)、以及產(chǎn)品的儲(chǔ)存條件的確定提供幫助。在各種降解試驗(yàn)中應(yīng)設(shè)立多種破壞程度,原料藥可以分別在固體和溶液狀態(tài)分別進(jìn)行強(qiáng)制降解試驗(yàn)。
對(duì)于仿制藥來(lái)說(shuō),如果已有充分的文獻(xiàn)資料對(duì)該藥的穩(wěn)定性及其降解途徑與降解產(chǎn)物進(jìn)行比較全面的闡述,則沒(méi)有必要進(jìn)行強(qiáng)制降解試驗(yàn)。同一個(gè)原料的不同晶型可能具有不同的穩(wěn)定性特征,當(dāng)一個(gè)仿制藥產(chǎn)品的晶型不同于原研產(chǎn)品晶型時(shí),應(yīng)該進(jìn)行多晶型穩(wěn)定考察試驗(yàn)。仿制藥的光降解試驗(yàn)不論結(jié)果怎樣,其說(shuō)明書(shū)都必須與原研保持一致。
7、結(jié)語(yǔ)
原料藥的強(qiáng)制降解試驗(yàn)應(yīng)該基于QbD原則,一個(gè)精心設(shè)計(jì)的強(qiáng)制降解試驗(yàn)研究對(duì)于分析方法的開(kāi)發(fā)是不可或缺的,它有助于建立一個(gè)穩(wěn)定的特異性指示方法和預(yù)測(cè)在穩(wěn)定性研究中的可能形成的潛在降解產(chǎn)物。同時(shí),強(qiáng)制降解試驗(yàn)可提供原料藥的物理、化學(xué)穩(wěn)定性方面的信息,為包材、儲(chǔ)存條件的選擇提供依據(jù)。
參考文獻(xiàn)
【5】FDA Perspectives: Scientific Consideration of Forced Degradation Studies in ANDA Submission

來(lái)源:ZMJ/藥事縱橫


