您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2020-05-22 09:29
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
「本文共:14條資訊,閱讀時長約:3分鐘 」
今日頭條
牛津大學新冠病毒疫苗動物實驗失敗。據印度快報,英國牛津大學開發的新冠病毒疫苗ChAdOx1 nCoV-19(腺病毒載體)在動物實驗中失敗。6只接種疫苗的獼猴在接觸新冠病毒后,鼻腔分泌物中病毒含量和沒接種疫苗的猴子含量相同。不過,在這6只全部感染新冠病毒的獼猴中,其中有3只猴子盡管呼吸急促,肺部卻沒有出現嚴重損害。該疫苗可能還是有部分的保護作用。目前這款疫苗正在進行的人體臨床試驗沒有被叫停。
國內藥訊
1.索凡替尼甲狀腺癌研究成果在Thyroid發文。和黃醫藥口服酪氨酸激酶抑制劑索凡替尼治療多種復發/難治性甲狀腺癌的Ⅱ期臨床結果積極。對于局部晚期/轉移性甲狀腺髓樣癌(MTC)、放射性碘難治性分化型甲狀腺癌(DTC)或無法接受放射性碘治療的局部晚期無法切除的復發性DTC患者,索凡替尼均顯示出了良好的治療效果和耐受性,這三類患者的ORR分別為22.2%、21.7%、33.3%;DCR分別為88.9%、87.0%、83.3%;中位PFS分別為11.1個月、11.1個月、尚未達到。該研究患者的總體ORR為23.2%,詳細數據發表在國際甲狀腺領域權威期刊Thyroid上。
2.諾誠健華不限癌種二代新藥獲批臨床。諾誠健華第二代泛TRK小分子抑制劑ICP-723片獲國家藥監局臨床試驗默示許可,擬開發用于治療攜帶NTRK融合基因的晚期或轉移性實體瘤。目前,第一代TRK抑制劑拉羅替尼和恩曲替尼已在攜帶NTRK融合突變的不同年齡、不同患癌組織的患者群中展示出抗癌活性。但對TRK抑制劑治療的獲得性耐藥仍然是個持續的挑戰,諾誠健華第二代TRK抑制劑有望解決一代耐藥性的問題。
3.阿諾醫藥EP4拮抗劑在華申報臨床。阿諾醫藥1類新藥AN0025在中國提交的臨床申請獲CDE受理。AN0025是一種EP4拮抗劑,已在歐美完成了針對晚期結直腸癌的Ⅰb期試驗。在ESMO 2019年會上公布的數據顯示,AN0025聯合標準療法對高風險局部晚期直腸癌病人進行新輔助治療的耐受性良好,有近40%的患者無需手術治療或術后標本達到病理完全緩解。本次是該藥首次在中國申報臨床。默沙東(MSD)已和阿諾醫藥達成合作,聯合開發AN0025和PD-1抗體Keytruda(帕博利珠單抗)聯合用藥的效果。
4.托珠單抗生物類似藥臨床試驗指導原則發布。CDE發布托珠單抗注射液生物類似藥臨床試驗指導原則,對該品種生物類似藥的臨床試驗設計、終點選擇和等效性界值提出建議。托珠單抗(雅美羅®)是羅氏研發的一款重組人源化抗IL-6單抗,已在中國獲批治療成人類風濕關節炎(RA)和全身型幼年特發性關節炎(sJIA)。目前原研產品序列專利已到期,國內外尚無托珠單抗生物類似物獲批上市。據悉,國內已有5家企業開展相關臨床試驗。
5.康希諾與PNI合作開發新冠病毒RNA疫苗。康希諾和加拿大Precision NanoSystems(PNI)公司將利用PNI公司的獨有RNA疫苗技術平臺,開發基于mRNA脂質納米顆粒(mRNA-LNP)技術的新冠病毒疫苗。PNI公司致力于開發生產納米藥物的技術。該公司已經開發出遞送核酸的脂質體配方文庫,而且開發出為遞送疫苗專門設計的脂質體配方。根據協議,PNI將負責疫苗開發,康希諾將負責臨床前檢測,臨床試驗,注冊和商業化推廣。康希諾同時獲得在亞洲(日本除外)地區推廣疫苗產品的權益,合作的金融細節尚未披露。
6.Zentalis成立的中國合資企業完成A輪融資。Zentalis Pharmaceuticals宣布完成Zentera Therapeutics的2000萬美元A輪融資。此次融資的領投方是Tybourne Capital Management和奧博亞洲基金。Zentalis通過其全資子公司成為Zentera的大股東,Zentalis首席執行官Anthony Sun博士將擔任Zentera的首席執行官。融資資金將用于在中國地區就Zentalis發現的3種癌癥療法和其他潛在候選創新藥物的開發和商業化,包括口服SERD(ZN-c5)、WEE1抑制劑(ZN-c3)和BCL-2抑制劑(ZN-d5)。
國際藥訊
1.“first-in-class”早衰癥靶向療法有望今年獲批。FDA已受理罕見病藥物開發公司Eiger BioPharmaceuticals開發的“first-in-class”異戊二烯化抑制劑Zokinvy(lonafarnib)治療早衰癥和早老樣核纖層蛋白病患者的新藥申請,并授予其優先審評資格。預計今年11月20日前做出回復。發表于2018年《美國醫學會雜志》上的一項研究數據顯示,接受lonafarnib單藥治療的早衰癥患者的死亡風險降低了88%,并獲得了顯著的生存獲益。最常報告的不良事件為胃腸道不良事件。許多早衰癥患者已連續接受超過10年lonafarnib的治療。
2.口服JAK抑制劑Filgotinib Ⅱb/Ⅲ臨床達主要終點。吉利德與Galapagos聯合開發的口服JAK抑制劑Filgotinib,在治療中重度潰瘍性結腸炎(UC)的Ⅱb/Ⅲ期臨床SELECTION中獲積極陽性結果。在未接受過生物治療的患者中,與安慰劑相比,Filgotinib 200mg組患者在第10周達到臨床緩解的比例更高(26.1%vs15.3%,p=0.0157),具統計學意義。在經過生物制劑治療的患者中,Filgotinib 200mg組患者在第10周達到臨床緩解的比例同樣具有顯著性差異(11.5%vs4.2%,p=0.0103)。在維持治療期間,在第58周時,Filgotinib的兩個劑量組均達主要終點。200mg filgotinib組臨床緩解率為37.2%(安慰劑組為11.2%,p?0.0001);Filgotinib 100mg組臨床緩解率為23.8%(安慰劑組為13.5%,p=0.0420)。
3.GSK達成開發基于CRISPR技術的新冠病毒檢測。葛蘭素史克的消費者健康部與Mammoth Biosciences公司達成協議,共同開發基于CRISPR技術的新冠病毒檢測。Mammoth Biosciences公司由CRISPR技術先驅Jennifer Doudna教授聯合創建。今年4月,該公司在Nature Technology上發表論文,描述了基于CRISPR-Cas12的新冠病毒檢測方法。據悉,該檢測可以在家進行,人們在20分鐘內在鼻拭子中即可檢測出新冠病毒的RNA。GSK和Mammoth預計在今年年底之前將向FDA遞交緊急使用授權的申請。
4.Surface Oncology與默沙東達成一項臨床合作。Surface Oncology開發的CD39抑制劑SRF617聯合默沙東PD-1抑制劑Keytruda即將開展Ⅰ/Ⅰb期臨床,評估該聯合療法治療胃癌和對PD-1產生耐藥癌癥患者的安全與療效。CD39是三磷酸腺苷(ATP)分解和腺苷生成過程中至關重要的酶。大量的研究證實了CD39在癌癥逃避免疫反應中的作用。CD39抑制劑會大幅度激活免疫系統,與抗PD-1療法相結合可增強激活作用,并且這種組合方法具有克服抗PD-1耐藥性的潛力。
5.阿斯利康獲10億美元新冠疫苗資助。5月21日,阿斯利康宣布,該公司從美國生物醫學高級研究和發展管理局(BARDA)獲得了超過10億美元的支持,用于今秋開始新冠病毒疫苗的開發、生產和交付。開發計劃包括一項有3萬名參與者的III期臨床和一項兒科試驗。阿斯利康此前已與牛津大學主持的新冠病毒疫苗項目(ChAdOx1 nCoV-19,現稱為AZD1222)達成合作,已簽署了至少4億劑的首批協議,并將于2020年9月開始首批交付。阿斯利康正與多個國家和多邊組織合作,使牛津大學的疫苗公平分配和分發至世界各地。
醫藥熱點
1.德國2萬余名醫護人員感染新冠病毒。據德國媒體19日報道,新冠疫情暴發以來,德國共有超過2.04萬名醫護人員感染新冠病毒,其中61人病亡,約1.91萬人康復。感染新冠病毒的醫護人員中,超過1.18萬人在醫院、診所等醫療機構工作,超過8500人在養老及照護機構工作。羅伯特·科赫研究所19日公布的新冠疫情數據顯示,截至當日零時,德國累計確診病例175210例,較前一日增加513例;累計死亡病例8007例,較前一日增加72例。
2.公共衛生防控救治能力建設方案發布。國家發改委等三部門發布《公共衛生防控救治能力建設方案》,提出五大建設任務.其中在全面改善疾控機構設施設備條件方面提出,實現每省至少有一個達到生物安全三級(P3)水平的實驗室,每個地級市至少有一個達到生物安全二級(P2)水平的實驗室。在健全完善城市傳染病救治網絡方面,每個城市選擇1-2所現有醫療機構進行改擴建,原則上100萬人口以下城市,設置病床60-100張;100-500萬人口城市,設置病床100-600張;500萬人口以上城市,設置病床不少于600張。
股市資訊
【開立醫療】公司產品電子支氣管內窺鏡已獲國家藥監局批準,于近日取得醫療器械注冊證。
【昭衍新藥】公司2018年授予的股票期權第二個行權期行權條件已經成就,同意達到考核要求的101名激勵對象在第二個行權期可行權股票數量為19.87萬份。
【泰格醫藥】公司控股企業DreamCIS Inc上市已取得韓國證券期貨交易所(KRX)的最終批準。
審評動向
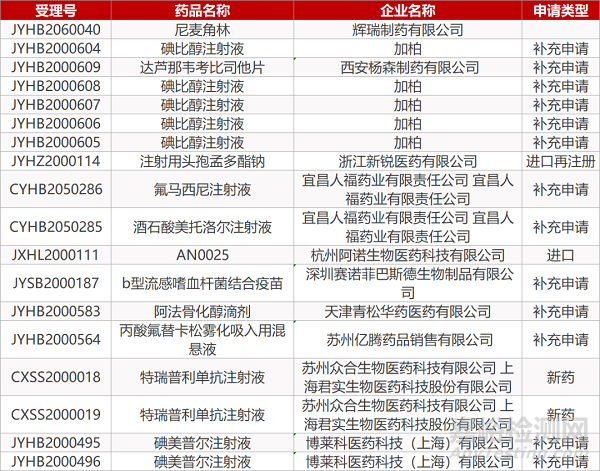
1. CDE最新受理情況(05月21日)
2. FDA最新獲批情況(北美05月20日)

- The End -

來源:藥研發


