您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2020-04-28 09:44
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
「本文共:15條資訊,閱讀時長約:3分鐘 」
綠谷九期一®獲批開展國際多中心Ⅲ期臨床。FDA已批準綠谷制藥原創治療阿爾茨海默病新藥甘露特鈉膠囊(九期一®)的國際多中心Ⅲ期臨床試驗申請。九期一®是一種以海洋褐藻提取物為原料的低分子酸性寡糖化合物,于2019年11月獲國家藥監局有條件批準上市,用于輕中度阿爾茨海默病,改善患者認知功能。據悉,這項研究將繼續聘請艾昆緯(IQVIA)負責項目管理,擬納入超過2000例患者,開展12個月的雙盲試驗和6個月的開放試驗。
1.北海康成「來那替尼片」國內即將獲批。北海康成引進新藥來那替尼(Neratinib,Nerlynx)的上市申請已變更為"在審批",預計下月獲批上市。來那替尼是一款由Puma公司研發的不可逆的泛HER酪氨酸激酶抑制劑,已于2017年7月獲FDA批準上市,成為全球首個獲批的用于HER-2陽性早期乳腺癌患者延長輔助治療的藥物,適用于既往接受過含有曲妥珠單抗藥物治療的成年患者,以降低乳腺癌復發風險。
2.再鼎醫藥甲苯磺酸奧瑪環素擬納入優先審評。再鼎醫藥抗感染新藥甲苯磺酸奧瑪環素(Omadacycline)上市申請獲CDE納入擬優先審評公示名單。該新藥由再鼎醫藥合作伙伴Paratek Pharmaceuticals開發,是一種新型四環素,其設計旨在克服四環素耐藥性,并具有廣譜抗菌活性,包括革蘭陽性菌、革蘭陰性菌、非典型病原體和多種耐藥菌株。該藥已于2019年2月在美國上市,用于治療社區獲得性細菌性肺炎及急性細菌性皮膚和皮膚結構感染,商品名為Nuzyra。
3.微生物群制劑聯合PD-L1獲FDA臨床批準。專注開發免疫腫瘤療法的Genome & Company宣布,FDA已批準其GEN-001與avelumab (Bavencio) 聯合治療實體癌癥患者的臨床試驗(IND)申請。GEN-001是一款在研的抗癌微生物群治療劑,avelumab則是默克和輝瑞共同開發的抗PD-L1抗體藥物。據悉,在臨床前研究中,通過增強抑制免疫檢查點抑制劑敏感和耐藥腫瘤模型生長的療效,GEN-001展示出了聯合免疫檢查點抑制劑的最佳安全性和協同效應。
4.拜耳1類創新藥sGC激動劑臨床申請獲受理。拜耳二代鳥甘氨酸環化酶(sGC)激動劑BAY 1101042鈉控釋片的臨床申請獲CDE受理。該新藥擬用于治療慢性腎功能衰竭,目前在全球處于Ⅰ期臨床開發階段。據Clinicaltrails.gov信息,BAY1101042在全球已完成的臨床研究有:單一口服10mg的BAY1101042片劑對男性和女性腎功能不全以及健康受試者的藥代動力學、安全性、耐受性和藥效學作用的臨床研究;健康男性受試者單劑和多劑口服BAY1101042片的藥代動力學,安全性,耐受性和藥效學作用的臨床研究。
5.諾華TIM-3抗體臨床申請獲CDE受理。諾華在研TIM-3靶向單抗MBG453的臨床試驗申請獲CDE受理。TIM-3是一種表達在免疫細胞和髓系白血病細胞表面的抑制性受體,它的表達水平與急性髓系白血病(AML)和骨髓增生異常綜合癥(MDS)的嚴重程度相關。目前,諾華正在開發MBG453用于AML和MDS的治療。在Ⅰ期臨床試驗中,MBG453在治療MDS和AML患者時已表現出良好的安全性和抗癌活性。全球范圍內尚無TIM-3單抗獲批。
1.強生抗炎藥Simponi Aria在美提交2份sBLA。強生旗下楊森向FDA提交了2份補充生物制品許可申請(sBLA),尋求批準抗炎藥Simponi Aria(golimumab,戈利木單抗),聯合甲氨蝶呤(MTX),用于2歲及以上患者治療多關節型幼年特發性關節炎(pJIA)和幼年銀屑病關節炎(jPsA))。如果獲批,Simponi Aria將成為可用于治療這些幼年關節炎的首個通過靜脈輸注的抗腫瘤壞死因子(TNF)-α生物制劑。在美國,Simponi Aria已獲批3個成人適應癥:中重度活動性類風濕性關節炎、活動性銀屑病關節炎、活動性強直性脊柱炎。
2.默沙東向FDA重新提交Keytruda補充申請。默沙東重新向FDA提交Keytruda每6周1次給藥方案(400mg,Q6W)補充生物制品許可申請(sBLA),該申請曾于2020年2月遭到FDA拒絕。Keytruda每6周1次給藥方案的補充申請是基于ASCO 2018大會上公布的藥代動力學數據,基于此數據,歐盟已于2019年3月批準了該給藥方案,適用于Keytruda單藥治療的適應癥。目前,FDA批準的Keytruda給藥方案為每3周1次(200mg,Q3W)。
3.奧拉帕利治療轉移性去勢抵抗前列腺癌III期研究成功。阿斯利康/默沙東宣布其PARP抑制劑Lynparza (奧拉帕利)在治療轉移性去勢抵抗前列腺癌((mCRPC)的III期PROfound研究中到達總生存期(OS)的次要終點。在BRCA1/2或ATM基因突變的mCRPC患者中,奧拉帕利較恩雜魯胺/阿比特龍顯著延長了患者OS。安全性方面與既往研究結果一致。具體數據將于醫學會議上公布。PROfound研究已在2019年8月到達了治療BRCA1/2或ATM基因突變(HRR基因突變的一個亞型)mCRPC患者的放射學無進展生存期(rPFS)的主要終點,并在所有HRRm患者中均到達了rPFS的次要終點。目前,Lynparza 該適應癥的補充新藥申請已獲FDA優先審評資格。
4.羅氏satralizumab治療NMOSD達Ⅲ期臨床終點。羅氏旗下日本藥企中外制藥宣布,評估IL-6R靶向單抗satralizumab(SA237)治療視神經脊髓炎譜系障礙(NMOSD)的全球III期研究SAkuraStar(NCT02073279)成果已在線發表于《柳葉刀神經病學》上。在整個研究人群(包括AQP4抗體陽性患者和陰性患者)中,與安慰劑相比,satralizumab將疾病復發風險顯著降低55%(HR=0.45[95%CI:0.23-0.89],p=0.018),達到雙盲期發生首次協議定義的復發(PDR)時間的主要終點。目前satralizumab正在接受美國、歐盟、日本監管機構的審查。
5.AdaptVac與AGC Biologics合作開發生產新冠肺炎疫苗。全球性生物制藥合同開發與制造組織AGC Biologics宣布,該公司將與AdaptVac合作開發和生產新冠肺炎疫苗。AdaptVac正與其歐盟“地平線2020”計劃(EU Horizon 2020)贊助的PREVENT-nCoV聯合合作伙伴攜手開發SARS-CoV-2疫苗。病毒樣顆粒是亞單位疫苗開發領域取得的重大進展,兼具高安全性和高療效,是疫苗抗原的理想載體。AdaptVac的病毒樣顆粒(VLP)技術可加快新冠肺炎疫苗的開發,有望在2020年底開始臨床試驗。
6.Sangamo和Mogrify公司合作開發即用型CAR-Treg療法。Mogrify公司和Sangamo公司達成一項研發合作,結合Mogrify專有的誘導多能干細胞(iPSCs)和胚胎干細胞(ESCs),以及Sangamo的鋅指蛋白(ZFP)基因工程技術,開發同種異體的嵌合抗原受體調節性T細胞(CAR-Treg)療法。根據協議,Mogrify將負責發現和優化從iPSCs或ESCs到Tregs的細胞轉化技術;通過ZFP技術,Sangamo將這些Tregs轉化為即用型同種異體CAR-Treg細胞候選療法,并負責臨床開發,直至注冊用于治療炎癥和自身免疫性疾病。Mogrify將獲預付款、開發和監管里程碑付款以及產品銷售分成。
1.生物安全法草案二審稿提請人大審議。生物安全法草案二審稿26日提請十三屆全國人大常委會第十七次會議審議。草案明確,采集、保藏、利用、對外提供我國人類遺傳資源,應當符合倫理原則,不得危害公眾健康、國家安全和社會公共利益。將我國人類遺傳資源信息向境外組織、個人及其設立或者實際控制的機構提供或者開放使用的,應當事先報告并提交信息備份;可能影響公眾健康、國家安全和社會公共利益的,還應當通過安全審查。
2.護士節《通知》強調解決護士后顧之憂。國家衛健委和國家中醫藥管理局聯合發布《關于做好2020年5·12護士節相關工作的通知》。《通知》強調,在薪酬待遇、職稱評聘、生活保障、休息休假、照顧幫扶等方面,堅決落實好相關保障政策措施,并按照有關規定給予表彰獎勵。同時,要切實為護士減負,對護士隊伍普遍反映的護理領域負擔過重、形式主義突出問題進行梳理排查,及時整治。另外,對侵犯護士人身安全、擾亂正常醫療秩序的行為予以嚴肅查處、嚴厲打擊,并加大宣傳力度。
3.廣州擬將新冠病毒抗體測定納入醫保。廣州市醫保局發布《關于嚴重急性呼吸綜合征冠狀病毒抗體測定項目價格的通知(征求意見稿)》,擬將冠狀病毒抗體測定納入廣州醫保范圍。根據該征求意見稿,嚴重急性呼吸綜合征冠狀病毒抗體測定擬制定醫療服務價格為:三級醫院50元/項,二級醫院45元/項,一級醫院40元/項。廣州地區定點醫療機構開展該項目的,按規定納入社會醫療保險統籌基金支付范圍。
【智飛生物】全資子公司安徽智飛龍科馬生物制藥有限公司研發的重組結核桿菌融合蛋白(EC)在國家藥監局網站的藥品注冊進度辦理狀態變更為“審批完畢-待制證”階段。
【恒瑞醫藥】2020年Q1實現營業收入55.27億元(+11.28%),歸母凈利潤為13.15億元(+10.30%),扣非歸母凈利潤12.76億元(+10.52%)。
【博騰股份】2019年年度權益分派方案為:以公司現有總股本剔除已回購股份后536,232,520.00股為基數,其中回購股份6,515,013.00股,向全體股東每10股派1.040000元人民幣現金。

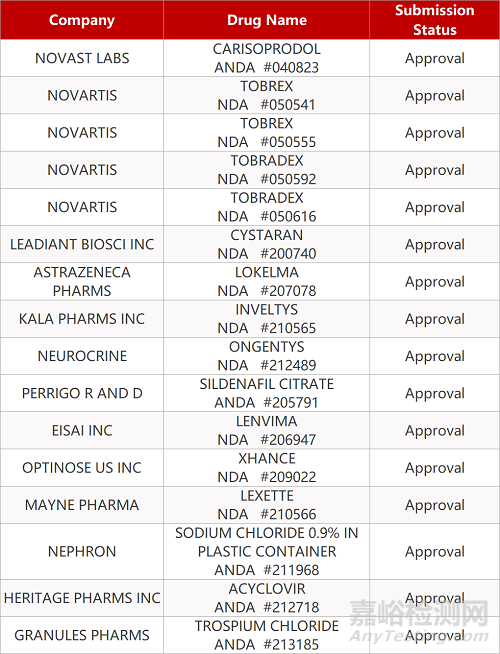
2. FDA最新獲批情況(北美4月24日)
- The End -

來源:藥研發


