您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2019-09-24 08:47
「本文共:15條資訊,閱讀時長約:3分鐘 」
今日頭條
拜耳“廣譜”抗癌藥larotrectinib獲歐盟批準。拜耳口服TRK抑制劑larotrectinib獲歐盟委員會批準,用于治療局部晚期、遠端轉移、無法手術切除或手術療效欠佳的且無滿意替代治療方案的神經營養性受體酪氨酸激酶(NTRK)基因融合的成人和兒童實體瘤患者。larotrectinib是歐盟首個批準的不區分腫瘤類型用于治療具有NTRK基因融合的抗癌藥物。此次獲批是基于102例患者臨床試驗數據的匯總分析,larotrectinib在NTRK融合的成人和兒童腫瘤患者中,包括中樞神經系統(CNS)腫瘤中均顯示出高效和持久的應答。目前該藥已在美國、巴西和加拿大獲批。
國內藥訊
1.默克西妥昔單抗新適應癥在華審批完畢。默克西妥昔單抗(愛必妥)的第二項適應癥上市申請審批狀態更新為"審批完畢-待制證"。繼2005年愛必妥獲國家藥監局批準轉移性結直腸癌適應癥之后,愛必妥的新適應癥極有可能為RAS野生型轉移性結直腸癌一線治療。愛必妥是靶向表皮生長因子受體(EGFR)的IgG1單克隆抗體。一項Ⅱ期OPUS試驗分析數據顯示,西妥昔單抗聯合FOLFOX一線治療KRAS野生型轉移性結直腸癌患者獲得良好的療效。另一項臨床CRYSTAL研究結果也顯示,西妥昔單抗聯合FOLFIRI一線治療野生型患者可將疾病進展危險度下降32%。
2.恒瑞公布卡瑞利珠單抗治療食管鱗癌的研究成果。恒瑞醫藥在CSCO大會上公布其PD-1抗體卡瑞利珠單抗治療食管鱗癌的研究成果。在Ⅲ期研究ESCORT中,與多西他賽或伊立替康相比,卡瑞利珠單抗單藥治療將既往接受一線化療失敗的晚期/轉移性食管鱗癌患者的總生存期(OS)顯著提高,達主要終點。在評估卡瑞利珠單抗聯合阿帕替尼和化療(紫杉醇脂質體+奈達鉑)一線治療晚期食管鱗癌的Ⅱ期臨床中,卡瑞利珠單抗聯合療法的客觀緩解率達80%,疾病控制率達96.7%,且不良反應可控、可預期。
3.君實生物PD-1多瘤種布局取得新突破。君實生物在CSCO大會上公布其PD-1抗體特瑞普利單抗治療膀胱尿路上皮癌和非小細胞肺癌(NSCLC)兩項Ⅱ期研究成果。在評估特瑞普利單抗單藥治療經標準治療失敗后的晚期局部進展或轉移性膀胱尿路上皮癌患者的POLARIS-03研究中,截至2019年9月5日,特瑞普利單抗的客觀緩解率(ORR)為26.4%,疾病控制率(DCR)為50.9%,緩解持續時間(DOR)為9.03周。PD-L1陽性患者ORR達42.4%。在評估特瑞普利單抗聯合化療(培美曲塞、卡鉑)治療EGFR突變陽性NSCLC的臨床研究中,特瑞普利單抗聯合方案的ORR為50%,DCR為87.5%,DOR為7.0個月,整體人群的中位PFS為7.0個月。其中PD-L1陽性患者的ORR為60%,中位PFS達8.2個月。
4.葆元醫藥公布ROS1/NTRK雙靶點抑制劑AB-106 研究成果。葆元生物在CSCO大會上公布其新一代ROS1/NTRK雙靶點抑制劑AB-106研究成果。在評估AB-106治療ROS1陽性非小細胞肺癌的I期臨床中,在18例可評估患者中,AB-106可使克唑替尼未治療組的ORR達66.7%,DCR達100%,PFS為24.9月;可使經克唑替尼治療組的ORR達33.3%,DCR達77.8%,PFS為7.6月;AB-106顯示良好的耐受性和安全性。此外,在美國的I期臨床中,有1例NTRK1融合基因陽性的甲狀腺癌患者經AB-106治療后達到PR,療效持續,目前患者已治療了35個月,仍在觀察隨訪之中。
5.榮昌生物公布HER2抗體偶聯藥物兩項研究成果。榮昌生物在CSCO大會上公布其新型HER2抗體偶聯藥物RC48-ADC的兩項研究數據。在評價RC48-ADC治療HER2陽性晚期乳腺癌的I/Ib期臨床中,RC48-ADC顯示出良好的療效和可控的安全性;1.5mg/kg劑量開始出現腫瘤應答,2.0mg/kg及2.5mg/kg治療效果顯著;RC48-ADC的安全性特點主要為輕中度的肝功能毒性等。在評估RC48-ADC治療HER2陽性局部晚期或轉移性尿路上皮癌患者的II期臨床中,獨立影像學評估的ORR為51.2%(95%CI: 35.5%, 66.7%),DCR為90.7%。整體中位PFS為6.9個月(95%CI 5.3~8.3),存在內臟轉移患者ORR為56.8%,既往接受過免疫治療患者的ORR為75.0%等,無特殊不良反應發生。
6.舒泰神STSG-0002注射液獲批臨床。舒泰神旗下國家I類治療用生物制品STSG-0002注射液獲國家藥監局臨床批件,STSG-0002注射液擬開發適應癥為慢性乙型肝炎。STSG-0002注射液為攜帶靶向HBV基因組P區和X區的shRNA序列表達框的肝噬性復制缺陷重組腺相關病毒,該療法采用重組腺相關病毒(rAAV)作為遞送載體。在采用HBV轉基因小鼠模型進行的臨床前有效性研究中,STSG-0002注射液表現出良好的有效性和長效性,在降低HBV相關抗原方面較已有的NAs類藥物恩替卡韋表現出明顯優勢。目前全球范圍內尚無該靶點基因藥物上市銷售。
國際藥訊
1.安斯泰來/琺博進宣布roxadustat在日本獲批。安斯泰來與琺博進聯合開發的首創HIF-PH抑制劑Evrenzo(roxadustat,羅沙司他)在日本獲批用于正在接受透析的患者治療慢性腎臟病(CKD)相關貧血。4項III期(1517-CL-0302,-0307,-0308,-0312)結果顯示,在接受透析的CKD貧血患者中,roxadustat能夠有效地提高血紅蛋白水平,并具有很好的耐受性。Roxadustat由琺博進發現,安斯泰來通過授權獲得其在日本、歐洲等市場的商業化許可權。roxadustat去年12月已在中國獲得全球首批,用于CKD透析患者的貧血治療。今年8月,該藥在中國獲批新的適應癥,用于非透析依賴性慢性腎臟病(NDD-CKD)患者的貧血治療。
2.安斯泰來靶向抗癌藥Xospata獲CHMP推薦批準。安斯泰來公司第二代FLT3抑制劑Xospata(gilteritinib)獲歐洲藥管局(EMA)人用醫藥產品委員會(CHMP)推薦批準,用于治療攜帶FLT3突變的復發/難治(藥物難治)急性髓性白血病(AML)成人患者。一項ADMIRAL臨床研究結果顯示,口服Xospata可使患者的CR/CRh(完全緩解率/伴部分血液學恢復的完全緩解)達21%、CR/CRh的中位緩解持續時間達4.6個月。基線期后56天,從依賴輸血向不依賴輸血的轉化率達31.1%。該藥在日本已獲批用于FLT3突變陽性復發/難治AML成人患者。
3.Aerie青光眼藥物Rhokiinsa獲歐盟CHMP推薦批準。Aerie公司首創Rho激酶抑制劑Rhokiinsa(netarsudil眼科溶液,0.02%)獲歐盟人用醫藥產品委員會(CHMP)推薦批準,用于原發性開角型青光眼或高眼壓成人患者,降低過高的眼內壓(IOP)。Rocklatan由固定劑量的拉坦前列素(latanoprost)和netarsudil組成。兩項III期研究(MERCURY 1,MERCYRY 2)結果顯示,Rocklatan達主要療效終點以及12個月的安全性和療效結果。Rocklatan治療組有超過60%的患者實現IOP降低30%或更多,這一比例大約是拉坦前列素組的2倍。Rocklatan組達到≤16mmHg和14mmHg的患者比例分別是拉坦前列素組的近2倍和近3倍。2017年12月Rhokiinsa已獲FDA批準用于開角型青光眼或高眼壓患者降低IOP。
4.vTv 口服葡萄糖激酶活化劑TTP399Ⅱ期臨床新數據。vTv 公司公布其肝選擇性葡萄糖激酶(glucokinase,GK)激動劑TTP399用于輔助治療1型糖尿病患者的Ⅱ期臨床Simplici-T1試驗的新數據。數據表明,與對照組相比,TTP399組患者血糖水平處于目標范圍內的時間比治療前基線每天增加了11%(2.7小時),而且在重要的清醒時間段(早7點到晚9點)正常血糖時間增加了12%(1.7小時);在血糖控制顯著改善的同時,TTP399治療組每日注射胰島素劑量減少23%,而對照組這一數值為4%;TTP399組患者的1級(54-70 mg/dl)和2級(<54 mg/dl)低血糖事件更少。
5.Regeneron/賽諾菲抗炎藥Dupixent發表兩項Ⅲ期臨床結果。Regenerong公司與賽諾菲聯合開發的IL-4/IL-13雙特異抑制劑Dupixent(dupilumab)治療鼻息肉慢性鼻竇炎(CRSwNP)的兩項Ⅲ期臨床研究(LIBERTY NP SINUS-24和LIBERTY NP SINUS-52)獲積極結果。724例CRSwNP成人患者(先前已接受手術或全身性皮質類固醇治療)參與這兩項試驗,結果顯示,Dupixent與皮質類固醇鼻腔噴霧劑聯用可縮小患者的鼻息肉,顯著降低鼻充血嚴重程度,達兩項試驗的相同主要終點;Dupixent可減輕患者的其它慢性鼻竇炎癥狀,改善患者的嗅覺;與安慰劑相比,Dupixent降低74%的皮質類固醇使用需求以及83%的手術需求;在同時患有哮喘的患者中,Dupixent顯示出對肺功能的改善以及對哮喘發作的控制;Dupixent具良好的安全性。
醫藥熱點
1.130家藥企研發投入批露。上市公司2019年上半年業績報告已披露完畢,據不完全統計,A股及港股上市藥企中,研發投入超過3000萬元的企業共有130家。130家藥企上半年研發投入合計約248.4億元,其中有52家藥企研發投入超過1億元,百濟神州、中國生物制藥、恒瑞、復星4家藥企研發投入均超過10億元;104家藥企研發投入同比去年有增長;32家研發投入占營業收入比重超過10%,TOP5企業均為港股上市藥企,分別為信達生物-B、百濟神州、君實生物-B、歌禮制藥-B、金斯瑞生物科技。
2.中國食管癌精準防治策略研究新進展。美國胃腸病學會(AGA)官方學術期刊《Clinical Gastroenterology and Hepatology》在線發表了北京大學腫瘤醫院柯楊教授團隊題為“Absence of Iodine Staining Associates with Progression of Esophageal Lesions in a Prospective Endoscopic Surveillance Study in China”的研究論文。該研究首次構建了食管病變進展的個體化風險預測模型,證明了內鏡下“碘染色異常特征”對早期低級別病變進展為高級別惡性病變的重要預警價值。
3.我國將建國家兒童腫瘤監測體系。國家衛健委近期正式批復同意國家兒童醫學中心(北京兒童醫院)設置國家兒童腫瘤監測中心,建立兒童腫瘤登記與監測體系,開展全國兒童腫瘤監測工作。國家癌癥中心2000年~2010年統計數據顯示,每年兒童腫瘤新發病例約2.2萬人,近10年來,0~14歲兒童腫瘤發病率年均增長達2.5%。發達國家兒童腫瘤5年生存率超過83%,我國這一數據為71.9%。目前,國家兒童腫瘤監測中心已開始成立專家組并建立監測平臺,預計2021年將全面開展工作。
【京新藥業】擬與山東省濰坊濱海經濟技術開發區管委會簽訂招商引資合同,在山東省濰坊濱海經濟技術開發區綠色化工園投資新建醫藥健康全產業鏈生產基地(原料藥、醫藥中間體為主),項目總用地面積約1000畝,總投資約40億元,分期、分階段實施。
審評動向
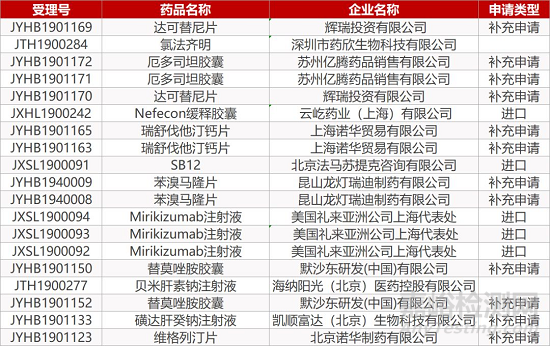
1. CDE最新受理情況(09月23日)
2. FDA最新獲批情況(北美09月22日)


來源:藥研發


