近日,器審中心發布了上海微創心通醫療科技股份有限公司的經導管主動脈瓣膜系統醫療器械產品注冊技術審評報告,從這份報告中,我們可以了解經導管主動脈瓣膜系統在研發階段需要做哪些檢測實驗。
醫療器械產品注冊技術審評報告
產品中文名稱:經導管主動脈瓣膜系統
產品管理類別:第三類
申請人名稱:上海微創心通醫療科技股份有限公司
產品審評摘要
一、產品概述
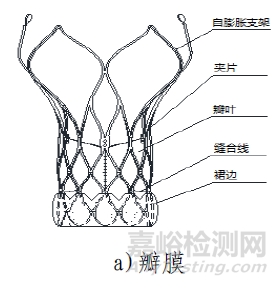
(一)產品結構及組成
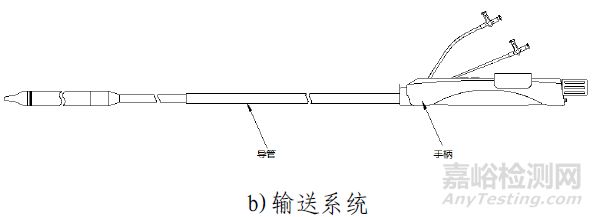
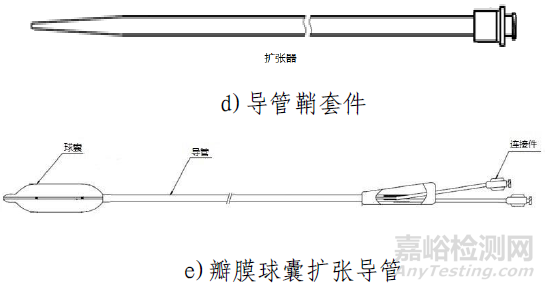
該產品由主動脈瓣膜、輸送系統、裝載工具、導管鞘套件以及瓣膜球囊擴張導管組成。使用時主動脈瓣膜瓣膜通過裝載工具被裝載進輸送系統中,導管鞘套件和可用于瓣膜預擴張/后擴張的瓣膜球囊擴張導管作為配套的附件。主動脈瓣膜由三片瓣葉(牛心包)、裙邊(PET)、夾片(鎳鈦合金)與自膨脹支架(鎳鈦合金)通過縫合線(PTFE)縫合而成。輸送系統主要由導管和手柄組成,含電池。導管鞘套件主要由導管鞘和擴張器組成。裝載工具包括導引座、導引蓋、保護管。瓣膜球囊擴張導管由非順應性球囊和導管以及連接件部件組成。主動脈瓣膜經化學液體滅菌,輸送系統、裝載工具、導管鞘套件以及瓣膜球囊擴張導管均經環氧乙烷滅菌。主動脈瓣膜貨架有效期為12個月;輸送系統(不含電池)、裝載工具、導管鞘套件有效期為24個月;電池有效期為6個月;瓣膜球囊擴張導管有效期為36個月。主動脈瓣膜在10-25℃條件下儲存和運輸。
(二)產品適用范圍
該產品適用于經心臟團隊結合評分系統評估后認為患有有癥狀的、鈣化的、重度退行性自體主動脈瓣狹窄,不適合接受常規外科手術置換瓣膜、年齡≥70歲的患者。
(三)型號/規格
產品的型號規格參見表1
(四)作用機理
本產品包括瓣膜、輸送系統、裝載工具、導管鞘套件和瓣膜球囊擴張導管五個部分。
a)瓣膜、輸送系統、裝載工具
產品采用微創介入治療方法,使用前通過裝載工具將瓣膜裝載進輸送系統內;使用時在醫學影像設備的監護下,通過建立好的血管通路將輸送系統推送至主動脈根部位置,操作輸送系統手柄完成瓣膜的釋放,將瓣膜固定在主動脈瓣環處,代替功能退化的瓣膜,使病人主動脈瓣功能得到改善。
b)瓣膜球囊擴張導管
瓣膜球囊擴張導管用于原生瓣膜預擴張以及經導管主動脈瓣膜植入后的后擴張。產品通過導絲推送至主動脈瓣環位置。注射器通過魯爾接口向通液腔中打入液體,使球囊充盈,從而完成預擴張和后擴張。
c)導管鞘套件
導管鞘套件用于手術過程中創建進入血管的經皮穿刺通道。
二、臨床前研究摘要
(一)產品性能研究
1.產品技術要求研究
技術要求研究項目如表2所示:
技術要求研究摘要
研究項目
1、瓣膜
尺寸
材料要求
外觀
裙邊縫合力
瓣膜流體力學性能
局部抗擠壓
抗移位性
植入短縮率
徑向支撐力
慢性向外力
裙邊瓣葉支架連接強度
瓣葉破裂強度
裙邊破裂強度
金屬支架腐蝕敏感性
金屬支架相變溫度Af點
可視性
耐久性
支架疲勞性
MRI相容性
還原物質
重金屬
酸堿度
蒸發殘渣
紫外吸光度
戊二醛殘留
無菌
細菌內毒素
熱皺縮溫度
瓣葉斷裂力
瓣葉縫合力
滲漏量
孔隙率
擴張短縮率
長度變化率
甲醛殘留
乙醇殘留
異丙醇殘留
2、輸送系統
尺寸
外觀
可視性
斷裂力
扭轉強度
無泄漏
耐腐蝕性
座
水合性
止血性
排空性
導絲通過性
瓣膜安裝性
瓣膜系統的過鞘性能
瓣膜與輸送系統連接強度
彎曲/扭結
推送性
追蹤性
釋放準確性
釋放時間
撤除性能
扭轉能力
扭轉性
扭轉結合強度
推送力
釋放力
手柄扭矩
導管絕緣電阻
手柄絕緣電阻
電氣安全要求
電磁兼容性要求
電氣設備環境要求
還原物質
重金屬
酸堿度
蒸發殘渣
紫外吸光度
環氧乙烷殘留
無菌
細菌內毒素
3、導管鞘套件
尺寸
外觀
可視性
座
斷裂力
導絲通過性
導管鞘無泄漏
導管鞘止血閥無泄漏
耐腐蝕性
扭轉強度
止血性
水合性
還原物質
重金屬
酸堿度
蒸發殘渣
紫外吸光度
環氧乙烷殘留
無菌
細菌內毒素
4、裝載工具
尺寸
2.3.2 外觀
還原物質
重金屬
酸堿度
蒸發殘渣
紫外吸光度
環氧乙烷殘留
無菌
細菌內毒素
5、瓣膜球囊擴張導管
尺寸
外表面
末端圓滑性(尖端構形)
連接件
導絲腔爽滑性
無泄漏
斷裂力
射線可探測性
耐腐蝕性
球囊爆破壓
疲勞性能
穿越性能
回抽時間
水合性
球囊順應性
還原物質
重金屬
酸堿度
蒸發殘渣
紫外吸光度
環氧乙烷殘留
無菌
細菌內毒素
2.產品性能評價
產品性能評價包括瓣膜的重量,連接強度,包裝性能,支架尺寸保持性,瓣膜彎曲性,瓣膜與主動脈根部適應性,輸送系統的器械標識,電池容量,防水性,包裝性能,排空性,瓣膜系統排空性,推送力,釋放準確性等性能驗證,并對瓣膜的清洗過程,瓣葉裁剪過程,瓣膜縫合過程,溶液配制過程,瓣膜抗鈣化過程,瓣膜滅菌過程,瓣膜封裝過程等工藝進行了驗證,結果表明產品符合設計輸入要求。
(二)生物相容性
該產品包含括瓣膜、輸送系統、裝載工具、導管鞘套件和瓣膜球囊擴張導管五個部分,其中瓣膜為植入器械,與循環血液長期接觸;輸送系統、導管鞘套件和瓣膜球囊擴張導管為外部接入器械,與循環血液短期接觸。裝載工具與人體間接接觸。申請人按照GB/T 16886 系列標準對所有部件分別進行了生物相容性評價,產品的生物相容性風險可接受,具體評價項目詳見表3。
表3 生物相容性評價項目表
(三)生物安全性
該產品的瓣膜部分采用了牛心包。申請人從原材料選取、原材料獲取、原材料和供應商管控、生產過程管控、產品處理工藝方法控制、質量體系保證等方面進行了論述,并參照標準GB/T 16886.20和動物源性醫療器械注冊技術審查指導原則等要求對瓣膜的抗鈣化,免疫原和病毒滅活的性能進行了驗證,結果符合要求,相關生物安全性風險可控。
(四)滅菌
該產品包含括瓣膜、輸送系統、裝載工具、導管鞘套件和瓣膜球囊擴張導管五個部分。其中瓣膜部分采用了化學滅菌方法,剩余的部件均采用環氧乙烷滅菌,無菌狀態提供。申請人提供了滅菌過程確認報告,證明無菌保證水平為10-6。
環氧乙烷殘留量不應大于10μg/cm2(其中輸送系統不應大于4mg/件)。
(五)產品有效期和包裝
瓣膜有效期為12個月;輸送系統(不含電池)、裝載工具、導管鞘套件有效期為24個月;電池有效期為6個月;瓣膜球囊擴張導管有效期為36個月。申請人提供了貨架有效期驗證報告。其中瓣膜、電池驗證實驗為實時老化,包括產品穩定性、包裝完整性和運輸模擬驗證;輸送系統、裝載工具(不含電池)、導管鞘套件以及瓣膜球囊擴張導管驗證實驗為加速老化和實時老化,包括產品穩定性、包裝完整性和運輸模擬驗證。
(六)動物研究
申請人開展了豬模型以及羊模型的動物實驗研究以驗證產品使用性能及安全性。評價指標包括有效性指標(瓣膜假體的急性功能、輸送系統的急性性能以及瓣膜假體的短期、中期和長期血液動力學性能)和安全性指標(瓣膜假體的長期生物學反應)。動物實驗結果表明,產品達到預期設計要求。
三、臨床評價摘要
(略)