您當前的位置:檢測資訊 > 熱點事件
嘉峪檢測網 2019-07-25 09:40
「本文共:15條資訊,閱讀時長約:3分鐘 」
今日頭條
正大天晴替諾福韋片獲歐盟上市許可。正大天晴富馬酸替諾福韋二吡呋酯片(晴眾)獲歐盟批準上市。晴眾成為正大天晴首個獲歐盟上市許可的制劑產品,也是我國首個獲準在歐盟上市的抗乙肝病毒一線藥物。替諾福韋是一種無環核苷酸類逆轉錄酶抑制劑,已被我國《慢性乙型肝炎防治指南》(2015年版)、美國肝病研究學會(AASLD)、歐洲肝病學會(EASL)以及世界衛生組織(WHO)等相關乙肝指南列為慢乙肝抗病毒治療的一線用藥。
國內藥訊
1.豪森HS-10342正式開展Ⅰ期臨床。豪森將正式開展HS-10342在晚期實體瘤患者中的Ⅰ期臨床試驗。HS-10342是由豪森研發的CDK4/6抑制劑,擬用于治療激素受體陽性人表皮生長因子受體2陰性的晚期乳腺癌。該品種2018年全球市場規模接近46億美元,其中,代表藥物輝瑞的哌柏西利2018年全球銷售額41.18億美元,位列2018全球最暢銷藥第10名。目前全球共批準上市了3款CDK4/6抑制劑:輝瑞的Palbociclib、諾華的Ribociclib以及禮來的Abemaciclib,其中,Palbociclib已在中國獲批上市。目前國內研發CDK4/6抑制劑的有恒瑞醫藥、正大天晴、貝達藥業等9家。
2.賽諾菲重磅抗炎新藥在華獲批臨床。再生元/賽諾菲的靶向2型炎癥反應的創新生物制劑Dupixent(dupilumab)獲國家藥監局臨床試驗默示許可,擬開發適應癥為2型炎癥表型的中重度慢性阻塞性肺疾病(COPD)患者的附加維持治療,以降低COPD急性加重的風險并改善肺功能。Dupixent是一款針對IL-4受體α亞基(IL-4Rα)的單抗,已獲FDA批準治療三項2型炎癥導致的適應癥,包括用于治療中重度濕疹(特應性皮炎)的成年患者;作為附加維持療法,治療嗜酸性粒細胞表型或口服皮質類固醇依賴性中重度哮喘患者;以及與其它藥物聯用治療伴有鼻息肉的慢性鼻竇炎成人患者。
3. 印度西普拉與江蘇創諾成立合資企業。西普拉歐洲公司(西普拉位于英國的全資子公司)與江蘇創諾制藥在中國成立一家合資公司。雙方共同出資3000萬美元,西普拉將持有合資公司80%的股份,創諾將持有20%的股份,合資公司成立后,將在中國投資建設吸入劑產品生產基地。西普拉是印度制藥行業排名第三的全球制藥公司,成立于1935年,專注于復雜仿制藥研發,涵蓋呼吸、抗逆轉錄病毒、泌尿、心臟和中樞神經系統等治療領域。江蘇創諾制藥是創諾醫藥集團的子公司。創諾醫藥集團是全球抗病毒和抗腫瘤原料藥的主要供應商。
4.基因編輯公司啟函生物完成新一輪融資。專注于異種器官移植的啟函生物完成超2000萬美元的B輪融資,招銀國際、聯想之星參與本輪融資。啟函生物成立于2017年,由CRISPR-Cas9基因編輯技術共同發明人之一的楊璐菡博士參與創建,致力于使用基因編輯技術生產出可用于人體移植的安全有效的細胞、組織和器官。目前,啟函生物正在進行基因編輯技術和器官移植技術的更進一步優化,通過改進基因編輯的通量和應用場景,提高基因編輯的精確性和可控性等。
5.上海醫藥集團與綠地集團達成戰略合作。綠地集團全資子公司綠地康養與上海醫藥集團旗下上藥藥材將充分發揮所在領域的行業優勢,將在中醫藥材市場占有、渠道鋪建、品牌引領、文化影響等方面展開合作。上藥藥材成立于1955年,是涵蓋中藥材種植,中藥飲片、中成藥、中藥保健品的制造和分銷,中醫醫療的大型中藥企業。綠地康養成立于2017年,公開資料顯示,該公司今年5月已戰略重組“貴州省藥材有限公司”,實現了綠地集團在中醫藥領域的首次布局。
國際藥訊
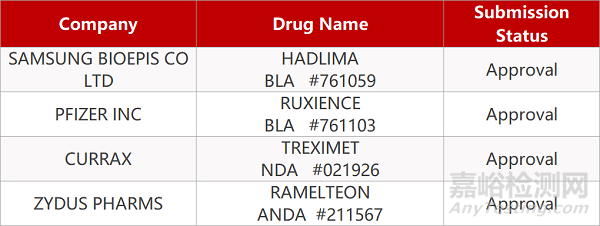
1.輝瑞仿制藥Ruxience獲FDA批準上市。輝瑞仿制藥Ruxience(利妥昔單抗-pvvr)獲FDA批準,用于治療成人患者非霍奇金淋巴瘤、慢性淋巴細胞白血病、肉芽腫伴多發性血管炎和顯微鏡下多血管炎,該藥是羅氏明星產品Rituximab的生物仿制藥。一項名為REFLECTIONS B3281006的臨床研究數據顯示,使用Ruxience一線治療CD20陽性、低腫瘤負荷的濾泡性淋巴瘤患者的客觀緩解率與使用羅氏Rituximab的效果相當。Ruxience是輝瑞今年獲FDA批準的第3款腫瘤學單抗類生物仿制藥,該藥的上市申請也已向歐盟提交,目前正在審核中。
2.三星Bioepis/默沙東Hadlima獲FDA批準。三星Bioepis /默沙東仿制藥Hadlima(adalimumab-bwwd,阿達木單抗)獲FDA批準,用于治療多種自身免疫性疾病,包括:類風濕性關節炎(RA)、幼年特發性關節炎(JIA)、銀屑病關節炎(PsA)等,該藥是艾伯維修美樂的生物仿制藥。544例RA患者接受Hadlima或阿達木單抗參考產品(ADL)治療。數據顯示,在第24周,Hadlima治療組的ACR20應答率為72.4%,ADL組為72.2%;Hadlima的安全性與ADL具有可比性。在第24周,ADL組的患者分組接受ADL或過渡到Hadlima治療,Hadlima治療組的患者繼續接受Hadlima治療。截至第52周,這三個治療組的療效、安全性和免疫原性仍具有可比性。
3.子宮肌瘤創新療法達Ⅲ期臨床終點。Myovant 公司在研relugolix組合療法在治療子宮肌瘤的Ⅲ期臨床LIBERTY2中獲積極結果。接受relugolix組合療法治療的患者中71.2%達預設的緩解標準這一臨床終點,安慰劑組的數值為14.7%(p<0.0001)。Relugolix組合療法組與基線相比的平均月經出血量減少84.3%,且從中重度疼痛緩解到無痛或輕微疼痛的患者比例顯著提高。臨床中,該療法具良好的安全性,沒有對患者骨密度產生顯著影響。預計年底前向FDA遞交新藥申請(NDA)。Relugolix組合療法每片包含relugolix (40 mg),雌二醇(1.0 mg),以及醋酸炔諾酮(0.5 mg)。
4.“first-in-class”艾滋病療法Ⅲ期臨床結果積極。ViiV Healthcare公司“first-in-class”抗病毒療法fostemsavir Ⅲ期臨床BRIGHTE結果積極。該研究在接受過多次前期治療的HIV-1患者中評估fostemsavir與優化背景治療(OBT)聯用的療效。結果顯示,第96周,fostemsavir與OBT治療組60%的患者(n=163/272)實現病毒學抑制(HIV-1 RNA<40拷貝/毫升),與第48周的結果相比增加6%。患者免疫指標的改善持續到96周,他們的CD4+ T細胞計數增加(與基線相比平均增加205個細胞/微升,與第48周相比,平均增加66個細胞/微升)。Fostemsavir是temsavir的前體藥物,該公司計劃在今年晚些時候向FDA提交其新藥申請。
5.艾滋病預防療法早期臨床結果積極。默沙東擬用于治療HIV感染的創新核苷類逆轉錄酶易位抑制劑(NRTTI)islatravir在Ⅰ期臨床中獲積極結果。在健康受試者的上臂中皮下植入裝有islatravir的藥物洗脫植入體,12周后摘除植入體。結果顯示,植入體能持續12周將受試者的外周血中單核細胞內islatravir的濃度保持在藥代動力學閾值以上。隨后的模擬研究表明,攜帶62毫克islatravir的植入體能將藥物濃度維持長達12個月以上。該療法有望成為一年只用藥一次的艾滋病暴露前預防(PrEP)療法。目前默沙東在多項臨床中檢驗它作為單藥PrEP療法和與其它抗病毒療法聯用治療HIV感染的療效。
6.Keytruda組合療法獲FDA突破性療法認定。默沙東(MSD)公司重磅PD-1抑制劑Keytruda(pembrolizumab)與衛材口服蛋白激酶抑制劑Lenvima(lenvatinib)組合療法獲FDA授予突破性療法認定,用于一線治療不能局部治療的晚期不可切除的肝細胞癌(HCC)患者。這也是該組合獲得的第三個突破療法認定。此次獲批是基于Ⅰb期試驗KEYNOTE-524/Study 116的最新中期結果。根據2018年3月默沙東與衛材達成的合作協議,這一免疫組合療法擬在6種不同癌癥(子宮內膜癌、非小細胞肺癌、肝細胞癌、頭頸癌、膀胱癌和黑色素瘤)中評估治療的效果。
醫藥熱點
1.北京協和醫院領導班子調整。在北京協和醫院干部大會上,國家衛健委人事司副司長段勇宣布該院領導班子調整決定:任命張抒揚同志為中國醫學科學院北京協和醫院(臨床醫學研究所)黨委書記,試用期一年;免去姜玉新同志中國醫學科學院北京協和醫院(臨床醫學研究所)黨委書記、副院(所)長職務。該官網顯示,張抒揚1986年畢業于北京醫科大學臨床醫學系,1991年獲協和醫科大學臨床醫學博士學位,1995年-1999年在美國做心臟科臨床博士后研究。作為主要研究者承擔和參與了國家多項研究課題,已發表學術論文150多篇。主編/譯專著9部。
2.輝瑞日本醫藥代表將執行提前退休計劃。據日媒報道,輝瑞日本公司開始執行提前退休計劃,目前已發布相關政策并募集提前退休人員。具體政策:募集對象為50歲以上的醫藥代表,募集人數在200人左右,截至日期是11月30日。對于提前離退的員工,將在普通退休金基礎上給予額外退休補貼。政策同時明確,腫瘤部門或其他罕見病藥物部門提前離退的醫藥代表,在離職后三年之內不得進入公司指定的競品公司上班,否則將被要求返還退休補貼金。
3.標簽出錯,拜耳召回近1000瓶血友病藥物。拜耳宣布追回近1000瓶標簽存在問題的藥品,并對涉及的患者發出了安全警告。拜耳發布的召回細節顯示,此次自愿召回涉及兩款藥物,召回原因是這些批次(批號27118RK和27119CG)的藥物被錯誤地貼上了血友病藥物Kogenate FS的成分標簽,實際上藥瓶內填充的卻是另一種血友病藥物——A型血友病凝血因子VIII藥物Jivi。市場上流通的標簽錯誤的藥物約有990瓶。
股市資訊
.
上個交易日 A 股醫藥板塊 +0.99%
漲幅前三 跌幅前三
京新藥業 +5.45% *ST 仰帆 -2.93%
*ST 瑞德 +4.79% 廣 生 堂 -2.46%
賽升藥業 +4.37% 太極集團 -2.40%
【賽升藥業】與綠竹生物簽署《技術轉讓合同》,綠竹生物將“人用單克隆抗體K3、K11”項目的相關技術轉讓給公司。
【衛光生物】(1)實現營業收入3.61億元,同比增長20.53%;歸母凈利潤7,053.31萬元,同比增長1.98%。(2)Wind一致增速-中報-Q2增速為無-1.98%-(-1.95%)。
【康泰生物】2017年限制性股票激勵計劃首次授予限制性股票第二個限售期可解除限售股份上市流通,本次解除限售的限制性股票數量為453.81萬股(總股本0.70%),實際可上市流通433.12萬股(總股本0.67%),上市流通日期為2019年7月29日。
審評動向
1. CDE最新受理情況(07月24日)
2. FDA最新獲批情況(北美07月23日)


來源:藥研發


