目的:建立羌活飲片中有機溶劑類成分的檢測方法。
方法:采用頂空氣相色譜法,以FID為檢測器,使用HP-INNOWAX(30 m×0.53 mm×1 μm)毛細管色譜柱,程序升溫,以氮氣為載氣,進樣口溫度230℃,檢測器溫度250℃,采用相應方法分別制備對照品溶液及供試品溶液,并采用頂空氣相色譜法-質譜聯用方法進行確認。
結果:3批樣品均出現與甲醇對照試劑保留時間一致的色譜峰,其余所測羌活飲片中均未出現與乙醇、丙酮等13種有機溶劑保留時間一致的色譜峰。
結論:本方法簡便靈敏,結果準確可靠,適用于羌活飲片中有機溶劑類成分的檢測。
羌活為我所承擔的2018年國家中藥材中藥飲片抽檢品種,現行標準為《中華人民共和國藥典》2015年版一部。我所共收到抽檢樣品202批次,其中14批次樣品標準檢驗不合格,并且14批次不合格樣品中有部分批次樣品性狀顏色淺、香氣弱、辛味弱、質地松泡,同時,羌活醇和異歐前胡素總量僅約為標準規定限度十分之一,懷疑此部分批次樣品為提取過的藥材殘渣,因此,采用頂空氣相色譜法對14批次不合格羌活飲片中甲醇、乙醇等13種溶劑殘留[1-4]進行篩查研究,并進一步采用氣質聯用法進行驗證。
1 溶劑殘留初篩
參照《國家藥包材標準》 [5]YBB00312004-2015中“包裝材料溶劑殘留量測定法”進行甲醇等12種溶劑殘留的篩查。
1.1 儀器與試藥
PE Clarus680氣相色譜儀;BP-211D電子天平(賽多利斯)。
試樣:1 4批次標準檢驗不合格羌活飲片(批號分別為171129、170401、170501、1641700601、170801、170617、151201、170501、170801、170301、170801、180301、180103、180101)、10批次標準檢驗合格羌活飲片(批號分別為20170101、171101、170318、20160701、CQ276171001、1705071、B703281、20170901、171013、1710101)。甲醇(色譜純,德國Merck公司);正己烷(色譜純,美國Sigma);丙酮、乙酸乙酯、丁酮、異丙醇、苯、甲苯、乙酸丁酯、乙苯、對二甲苯、間二甲苯、鄰二甲苯(分析純,國藥集團化學試劑北京有限公司)。
1.2 供試品溶液的制備
精密稱取樣品1 g,置頂空瓶中,壓蓋,密封,即得。
1.3 對照品溶液的制備
分別取丙酮、乙酸乙酯、甲醇、丁酮、異丙醇、苯、甲苯、乙酸丁酯、乙苯、對二甲苯、間二甲苯、鄰二甲苯12種有機試劑適量,加正己烷制成每1 mL含0.4 mg的溶液。分別吸取上述對照品溶液各5 μL,加正己烷10 μL,置于頂空瓶中,即得。
1.4 氣相色譜條件
HP-INNOWAX(60 m×0.32 mm×0.5 μm)毛細管色譜柱;FID檢測器;柱溫:起始50 ℃,保持5 min,再以10 ℃·min-1的速率升溫至150 ℃;進樣口溫度200℃;檢測器溫度220 ℃;進樣量1 μL;進樣方式為分流進樣,分流比10︰1;氫氣40 mL·min-1,空氣400 mL·min-1;頂空溫度110 ℃,振搖60 min。
1.5 初篩結果
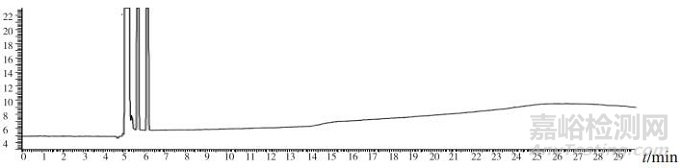
3批次標準檢驗不合格樣品(批號分別為170617、151201、170501)色譜圖中,均出現與甲醇對照試劑保留時間相同的色譜峰,其余樣品中均未出現與甲醇等12種有機溶劑保留時間一致的色譜峰(見圖 1~3)。
圖 1 正己烷空白溶劑
1.丙酮;2.乙酸乙酯;3.甲醇;4.丁酮;5.異丙醇;6.苯;7.甲苯;8.乙酸丁酯;9.乙苯;10.對二甲苯;11.間二甲苯;12.鄰二甲苯。
圖 2 12種有機溶劑氣相色譜圖
圖 3 供試品(批號170501)氣相色譜圖
2 甲醇溶劑殘留方法建立及驗證
2.1 氣相色譜條件
HP-INNOWAX(30 m×0.53 mm×1 μm)毛細管色譜柱;柱溫:初始37 ℃,保持8 min;以5 ℃·min-1的速率升溫至55 ℃,保持5 min;再以30 ℃·min-1的速率升溫至220 ℃,保持10 min;進樣口溫度:230 ℃;檢測器溫度:250 ℃;分流比:20︰1,氫氣40 mL·min-1,空氣400 mL·min-1;頂空溫度:80 ℃,振搖30 min。
2.2 儀器與試藥
島津GC-2010Plus氣相色譜儀、Agilent 6890N-5925B氣質聯用儀;MS-204S天平(METTLER TOLEDO)。14批次標準檢驗不合格羌活飲片;3批次符合規定的羌活樣品(批號分別為180100171、18040301、20180401)。甲醇(色譜純,德國Merck公司);乙醇(色譜純,德國Merck公司);水為純化水。
2.3 供試品溶液的制備
2.3.1 自制陽性樣品的制備
選取符合標準規定的3批樣品(批號分別為180100171、18040301、20180401),進行模擬試驗,各稱取50 g,分別加甲醇300 mL,加熱回流1 h,濾過,藥渣置于陰涼處晾干,作為自制陽性樣品。分別將3批自制陽性樣品進行粉碎,各取1 g,精密稱定,置頂空瓶中,立即密封,即得。
2.3.2 樣品的制備
精密稱取各樣品1 g,置頂空瓶中,壓蓋,密封,即得。
2.4 對照品溶液的制備
取甲醇適量,加水制成每1 mL含1 mg的溶液;取乙醇適量,加水制成每1 mL含1 mg的溶液;分別精密吸取上述甲醇、乙醇對照試劑溶液2 mL,置于頂空瓶中,即得。
2.5 專屬性考察
取10批次標準檢驗合格的羌活樣品,按照“2.1”節下色譜條件依法測定,結果表明:在甲醇對照試劑保留時間處,均無干擾,專屬性良好。
2.6 耐用性
使用島津GC-2010Plus氣相色譜儀,HPINNOWAX(30 m×0.53 mm×1μm)毛細管色譜柱和DM-5(30 m×0.32 mm×0.25 μm)毛細管色譜柱,均具有良好的分離度和塔板數,表明本方法耐用性良好。
2.7 檢測限
將甲醇對照試劑稀釋1000倍,吸取2 mL置頂空瓶中,進樣即得,結果方法檢出限為1.656 μg·g-1。
2.8 測定結果
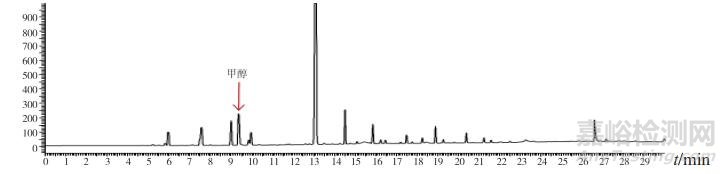
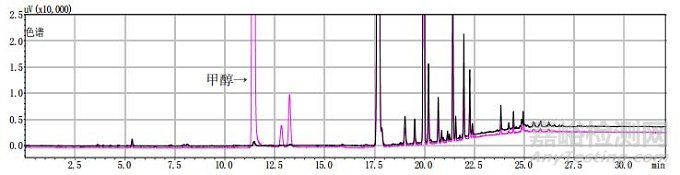
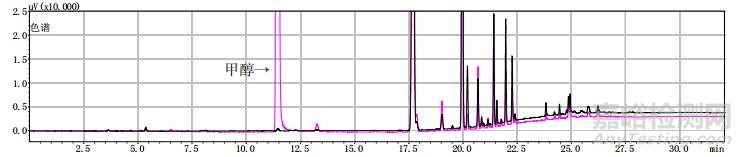
分別將甲醇對照試劑溶液、乙醇對照試劑溶液、3批自制陽性樣品及14批次標準檢驗不合格羌活樣品,按上述“2.1”色譜條件進行測定。結果:3批標準檢驗不合格樣品(批號分別為170617、151201、170501)及3批自制陽性樣品的氣相色譜圖中,均未出現與乙醇對照試劑保留時間一致的色譜峰,但均出現與甲醇對照試劑保留時間一致的色譜峰,且其他色譜峰(特別是保留時間段17~27 min)缺失嚴重(見圖 4~11)。
圖 4 甲醇對照試劑氣相色譜圖
圖 5 乙醇對照試劑氣相色譜圖
圖 6 疑似樣品(批號170617)氣相色譜圖
圖 7 疑似樣品(批號151201)氣相色譜圖
圖 8 疑似樣品(批號170501)氣相色譜圖
黑色為提取前,粉色為提取后。
圖 9 樣品(批號180100171)甲醇提取前后氣相色譜圖
黑色為提取前,粉色為提取后。
圖 10 樣品(批號20180401)甲醇提取前后氣相色譜圖
黑色為提取前,粉色為提取后。
圖 11 樣品(批號18040301)甲醇提取前后氣相色譜圖
2.9 甲醇檢出限度的確定
3批模擬陽性樣品在甲醇提取前也出現與甲醇對照試劑保留時間一致的色譜峰,量值為50 μg·g-1,以此值作為限度。測定結果表明3批疑似樣品檢出的甲醇量與羌活自身檢出的甲醇量(50 μg·g-1)相比從40倍到3980倍不等。
2.10 GC-MS確認
2.10.1 質譜條件
Rtx-WAX MS(30 m×0.25 mm×0.25 μm)毛細管色譜柱;FID檢測器;柱溫為程序升溫:初始37 ℃,保持8 min;以5 ℃·min-1的速率升溫至55 ℃,保持5 min;再以30 ℃·min-1的速率升溫至220 ℃,保持10 min;進樣口溫度:230 ℃;分流比:10︰1;頂空溫度:80℃,振搖30 min。
2.10.2 質譜確認結果
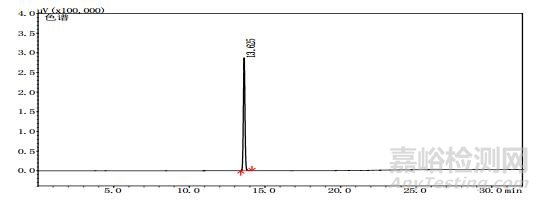
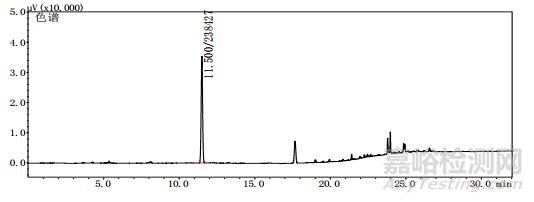
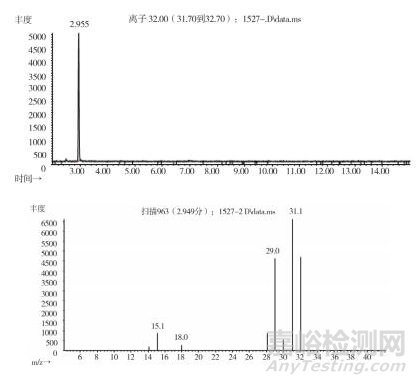
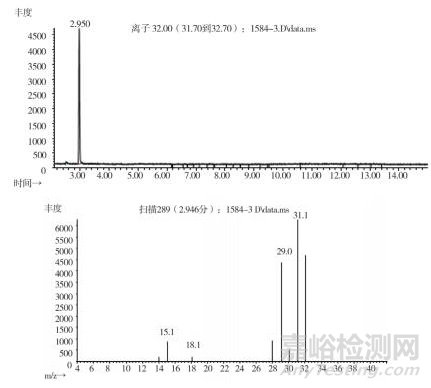
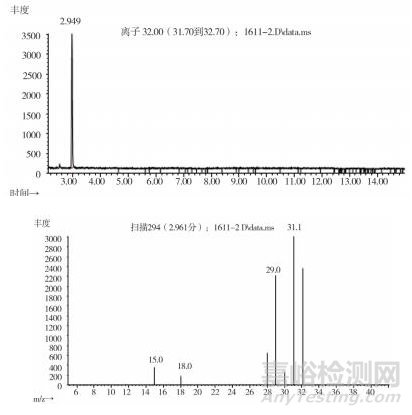
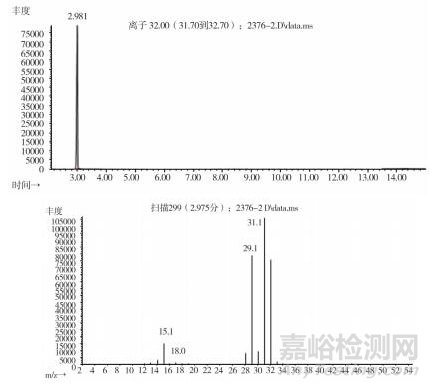
取上述3批疑似檢出甲醇樣品(批號分別為170617、151201、170501)、3批模擬陽性樣品,各1 g,置頂空瓶中,壓蓋,密封,按“2.10.1”質譜條件進行測定。結果:3批樣品(批號分別為170617、151201、170501)、3批模擬陽性樣品與甲醇對照試劑的總離子流色譜及一級質譜圖一致(見圖 12~19)。
圖 12 空白溶劑氣質色譜圖
圖 13 甲醇對照試劑氣質色譜圖
圖 14 疑似樣品(批號170617)氣質色譜圖
圖 15 疑似樣品(批號151201)氣質色譜圖
圖 16 疑似樣品(批號170501)氣質色譜圖
圖 17 模擬陽性樣品(批號180100171)氣質色譜圖
圖 18 模擬陽性樣品(批號18040301)氣質色譜圖
圖 19 模擬陽性樣品(批號20180401)氣質色譜圖
3 討論
3.1 可能帶來甲醇的原因分析
10批次標準檢驗合格的樣品也出現與甲醇對照試劑保留時間一致的色譜峰,但量值很小(50 μg·g-1)。據有關學者考證,高等植物在正常的生長發育過程中,植物體內會產生甲醇、甲醛和甲酸[6-7],其中甲醇主要來源是果膠和木質素的脫甲基作用[8],此外,通過甲醛歧化作用或還原作用也可以產生甲醇[9]。甲醇除了部分從氣孔中釋放外,植物還能通過自身的甲醇代謝反應將剩余甲醇消耗掉,防止甲醇過度積累而影響正常的代謝活動[10]。雖然高等植物在正常代謝過程中可以通過自身代謝消耗掉部分甲醇,但是具體在植物中參與循環的甲醇比例還不清楚,可以肯定的是植物組織確實能夠代謝甲醇。在新鮮葉片和種子中甲醇含量相對要高,在種子中最大能蓄積到90 μg·g-1[11]。
結合本次抽樣環節和樣品來看,并未有樣品出現霉變或儲存不當等其他情況而使其中甲醇含量急劇升高的現象,因此,基本可以排除是樣品自身的原因導致甲醇含量升高。由于時間較緊,本次研究未建立羌活飲片中有機溶劑類成分的含量測定方法,但從測定結果來看,有部分批次樣品中甲醇含量較高,并且參考《中華人民共和國藥典》2015年版四部通則0861“殘留溶劑測定法”中甲醇的限度為0.3%[12],3批樣品中甲醇量的值遠高于此限度,可能也存在有機溶劑提取并且未能完全去除有機溶劑的現象,應予以重視。在今后的工作中也要進一步建立相關含量測定方法,并增加相應的測定批次,以確定羌活中甲醇的來源情況。
3.2 檢出甲醇量高的樣品來源
3批檢出甲醇量高的樣品被抽樣單位分別是中醫診所和醫藥公司,而非標示生產企業。其中,標示同一生產企業同一批號的羌活樣品有兩批,一批被抽樣單位標示為生產企業,標準檢驗是合格的;而另一批被抽樣單位是醫藥公司,標準檢驗不合格并且檢出甲醇量值很高。
3.3 溶劑殘留篩查的意義
藥品中的殘留溶劑是指在原料藥或輔料的生產中,以及在制劑制備過程中使用的,但在工藝過程中未能完全去除的有機溶劑。當藥材飲片中所含的殘留溶劑水平高于安全值時,對人體或環境將產生危害,殘留溶劑的檢測已經越來越受到行業的重視。本文采用頂空氣相色譜法對羌活飲片中的有機溶劑殘留進行檢測,并進一步采用氣相質譜法進行了確認,檢測結果表明有3批羌活樣品出現與甲醇對照試劑保留時間一致的色譜峰,應予以重視。
參考文獻
[1] 吳春麗, 張俊霞, 史云濤, 等. 頂空毛細管氣相色譜法測定來曲唑原料藥中有機溶劑殘留量[J]. 中國藥房, 2010, 21(17): 1601-1603.
[2] 田文橋, 李少茹, 王靜怡, 等. 頂空氣相色譜法測定新藥五味子乙素中有機溶劑的殘留量[J]. 西北藥學雜志, 2015, 28(5): 441-443.
[3] 曹玉. 頂空進樣毛細管氣相色譜法測定鹽酸普拉克索中的殘留溶劑[J]. 中國當代醫藥, 2015, 22(35): 7-10.
[4] 劉薇芝, 胡漢昆, 劉萍, 等. 頂空毛細管氣相色譜法測定硝酸異康唑中5種有機溶劑殘留[J]. 中國醫院藥學雜志, 2016, 36(1): 9-12.
[5] YBB00312004-2015包裝材料溶劑殘留量測定法[S].國家藥包材標準, 2015: 287-288.
[6] 徐迪, 陳麗梅, 年紅娟, 等. 高等植物中一碳化合物代謝研究進展[J]. 西北植物學報, 2009, 29(6): 1284-1289. DOI:10.3321/j.issn:1000-4025.2009.06.035
[7] 衛培培, 於丙軍. 甲醇對植物的作用及其生理機制[J]. 西北植物學報, 2014, 34(2): 416-422.
[8] FALLR, BENSON A A. Leaf Methanol-the Simplest Natural Product from Plants[J]. Trends in Plant Science, 2006, 1(9): 296-301.
[9] MASON R P, SANDERS JEREMY K M, GIDLE Y M J. NMR Visualization of Free Asparagine in Potato Tissue Using Adduct Formation with[13C] Formaldehyde[J]. Phytochemistry, 2005, 25(7): 1567-1571.
[10] NEMECEK-MARSHA LL M, MACDONALD R C, Franzen J J, et al. Methanol Emission from Leaves (Enzymatic Detection of Gas-phase Methanol and Relation of Methanol Fluxes to Stomatal Conductance and Leaf Development)[J]. Plant Physiol, 1995, 108(4): 1359-1368. DOI:10.1104/pp.108.4.1359
[11] RALPH L. OBENDORF5, JAMES L. KOCH2, RYSZARD J GORECKI3, et al. Ethanol Accumulation in Maturing Seeds[J]. Journal of Experimental Botany, 1990, 41(225): 489-495. https://www.researchgate.net/publication/31390653_Methanol_Accumulation_in_Maturing_Seeds
[12] 中華人民共和國藥典: 一部[S]. 2015: 105-107.